
(3分)某盐矿井采出的食盐(俗称井盐)中含有CaCl2,为设计除杂方案需测定CaCl2的含量,准确称量上述井盐22.8g,向其中加入100g质量分数为10.6%的Na2CO3溶液恰好完全反应,且所得食盐溶液仍为不饱和溶液。求:
(1)井盐中CaCl2的质量分数。
(2)检测后的溶液中NaCl的质量分数。
(1)48.7% (2)20.7%
解析试题分析:(1)要求井盐中CaCl2的质量分数,可根据化学方程式以及Na2CO3的质量,计算出井盐中CaCl2的质量,然后再根据质量分数公式就可求出井盐中CaCl2的质量分数;
解:设22.8g井盐中含CaCl2的质量为X,加入Na2CO3溶液后生成NaCl的质量为Y,CaCO3沉淀的质量为Z。
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
111 106 100 117
X 100g×10.6% Z Y
111:106= X:100g×10.6%
106:100=100g×10.6%:Z
106:117=100g×10.6%:Y
解得X=11.1g,Y=11.7g,Z=10g
所以CaCl2的质量分数=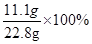 ="48.7%"
="48.7%"
(2)欲知检测后溶液中NaCl的质量分数,须知检测后NaCl的质量及溶液质量,NaCl的质量要包括原来的氯化钠和反应生成的氯化钠,溶液质量为总质量-生成沉淀的质量,再根据溶质质量分数公式计算即可。
由上面的计算可知,22.8g井盐中含NaCl的质量为22.8g-11.1g=11.7g;
故反应后溶液中含NaCl的质量为11.7g+11.7g=23.4g
所以溶液中NaCl的质量分数为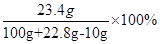 ="20.7%"
="20.7%"
答:井盐中CaCl2的质量分数为48.7%,检测后的溶液中NaCl的质量分数为20.7%
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
点评:此题是关于化学方程式及溶质质量分数的计算题,主要是利用反应方程式来分析和解决化学计算中的有关问题,要求学生要有较强的分析能力,解题的关键是要明确所求溶液的溶质是什么,有几部分组成;然后根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:2010-2011学年北京市门头沟区中考一模化学试卷 (解析版) 题型:计算题
(3分)某盐矿井采出的食盐(俗称井盐)中含有CaCl2,为设计除杂方案需测定CaCl2的含量,准确称量上述井盐22.8g,向其中加入100g质量分数为10.6%的Na2CO3溶液恰好完全反应,且所得食盐溶液仍为不饱和溶液。求:
(1)井盐中CaCl2的质量分数。
(2)检测后的溶液中NaCl的质量分数。
查看答案和解析>>
科目:初中化学 来源:门头沟区一模 题型:问答题
查看答案和解析>>
科目:初中化学 来源:2011年北京市门头沟区中考化学一模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com