【答案】
分析:(1)乙醇在氧气中完全燃烧,生成二氧化碳和水,据此写出化学方程式即可;
(2)解这类题时首先要考虑这些物质有无直接的检验方法.如,用无水硫酸铜检验水;用石灰水检验二氧化碳等.当需要检验一氧化碳时,一定要先除净(要检验)二氧化碳,然后再通过灼热氧化铜.最后用石灰水检验是否生成了二氧化碳;
(3)根据乙醇燃烧的化学方程式计算即可.
解答:解:(1)乙醇完全燃烧的化学方程式为:C
2H
5OH+3O
2
2CO
2+3H
2O;
(2)-(6)①装置④所盛的是无水硫酸铜(或CuSO
4),无水硫酸铜是白色,吸水后呈蓝色.故如果装置④所盛的药品变成蓝色,则说明乙醇燃烧产物有H
2O;
②装置②中,气体通过A瓶时,二氧化碳可与氢氧化钙反应生成碳酸钙沉淀,故如果A中有沉淀生成,则证明乙醇燃烧产物有CO
2;如果乙醇燃烧产物有CO
2,且在A瓶中没有反应完,则剩余的二氧化碳气体还可与B瓶中的氢氧化钠溶液反应,这样,就可以除去CO
2;如果二氧化碳过B瓶没有被除尽,则通过C瓶时,还会有沉淀生成.故C瓶的作用是验证混合气体中的CO
2是否已被除尽;
③此时,乙醇燃烧产物中的CO、CO
2、H
2O就只剩下CO了.在把剩余气体通过装置③,因为一氧化碳在加热的条件下,可与氧化铜发生还原反应,还原出Cu;
④装置①的瓶中是澄清的石灰水,让气体继续通过装置①,如果有沉淀生成,则证明乙醇燃烧产物有CO(因为一氧化碳与氧化铜反应,生成Cu和二氧化碳,二氧化碳可使澄清的石灰水变浑浊);
⑤最后气体如有剩余,则是一氧化碳气体(有毒,可燃烧),故可以点燃去除,也可收集作为燃料.
(7)设参加反应的乙醇质量为x,
C
2H
5OH~~~3H
2O
46 54
x 10.8g
∴46:54=x:10.8g,解之得:x=9.2g;
所以二氧化碳和一氧化碳的质量和为27.6g-10.8g=16.8g
设一氧化碳的质量为y.根据碳元素质量守恒可得
9.2g×
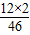
×100%=y×
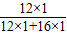
×100%+(16.8g-y)×
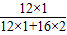
×100%
y=1.4g.即一氧化碳的质量为1.4g
(8)根据甲烷和乙醇完全燃烧的化学方程式可得:
乙醇质量:二氧化碳质量=46:88,
甲烷质量:二氧化碳质量=16:44,
由此可以看出,完全燃烧产生温室气体CO
2较多的是甲烷.
故答案为:(1)C
2H
5OH+3O
2
2CO
2+3H
2O.
(2)④②③①.
(3)验证CO
2存在;除去混合气体中的CO
2;验证混合气体中的CO
2是否已被除尽.
(4)将CO氧化成CO
2;澄清石灰水[或氢氧化钙、Ca(OH)
2];检验由CO与CuO反应所生成的CO
2,从而确证有CO气体.(5)无水硫酸铜(或CuSO
4);H
2O(或水).
(6)点燃(或:燃烧、收集).
(7)9.2g;1.4g.
(8)甲烷.
点评:此题主要是考查同学们的综合分析能力,不但要求同学们具备有关化合物的基础知识,而且要有实验操作的经历和分析、解决化学实验问题的能力.解题时需要认真分析题目给出的条件,联系实际,逐一分析推断.




 2CO2+3H2O;
2CO2+3H2O;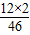 ×100%=y×
×100%=y×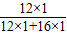 ×100%+(16.8g-y)×
×100%+(16.8g-y)×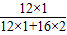 ×100%
×100% 2CO2+3H2O.
2CO2+3H2O.




