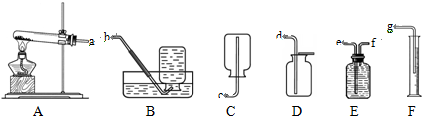
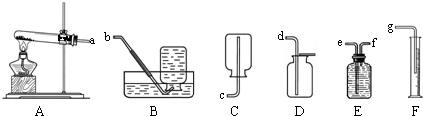
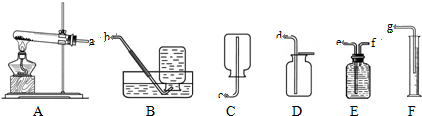
解:(1)高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,配平即可,方程式是2KMnO
4
K
2MnO
4+MnO
2+O
2↑;通过排水量来测定所收集到氧气的体积,整套实验装置接口的正确连接顺序为a→f→e→g;
(2)甲同学观察到E装置中的水变为紫红色,这是因为:试管口没有放棉花团,高锰酸钾粉末进入导管的缘故;因此用高锰酸钾时,试管口要有一团棉花;
(3)作出猜想:化学反应前后元素的种类不变,因为锰酸钾和二氧化锰中都含有氧元素,所以可能是锰酸钾和二氧化锰共同放出氧气;
实验验证:冷却后测得二氧化锰的质量不变,证明猜想Ⅰ和Ⅲ错误;取少量锰酸钾于试管中加,热一段时间,冷却后测得锰酸钾的质量减少,证明猜想Ⅱ正确;
反思拓展:要测定空气中氧气的体积分数,实验方案步骤是:先用电子天平称出金属粉末的质量;再把金属粉末在带瓶塞的1000ml烧瓶灼烧,至氧气充分反应;再称量反应后金属粉末的质量,与反应前金属粉末的差值就是反应的烧瓶中氧气的质量,然后通过密度公式求氧气的体积,结合1000mL空气的体积计算出氧气的体积分数;
故答案为:
(1)2KMnO
4
K
2MnO
4+MnO
2+O
2↑; f→e→g;
(2)高锰酸钾粉末;在试管口放一团棉花;
(3)作出猜想:可能是锰酸钾和二氧化锰均被分解放出氧气; 锰酸钾和二氧化锰都含有氧元素;
实验验证:Ⅰ和Ⅲ; 冷却后测得固体残留物的质量较原固体减少;
反思拓展:先用电子天平称出稍过量的金属粉末的质量,再把金属粉末放在带瓶塞的1000mL的圆底烧瓶中灼烧,至氧气完全反应;再称量反应后圆底烧瓶中固体物质的质量;最后通过密度公式求氧气的体积.
分析:(1)依据高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气书写方程式;通过排水量来测定所收集到氧气的体积,所以整套实验装置接口的正确连接顺序为a→f→e→g;
(2)用高锰酸钾时,试管口要有一团棉花,防止高锰酸钾粉末进入导管;
(3)作出猜想:根据质量守恒定律反应前后元素的种类分析,锰酸钾和二氧化锰中都含有氧元素,所以可能是锰酸钾和二氧化锰共同放出氧气;
实验验证:冷却后测得二氧化锰的质量不变,证明猜想Ⅰ和Ⅲ错误;取少量锰酸钾于试管中加,热一段时间,冷却后测得锰酸钾的质量减少,证明猜想Ⅱ正确;
反思拓展:实验方案的步骤是:先用电子天平称出金属粉末的质量;再把金属粉末放在带瓶塞的1000ml烧瓶灼烧,至氧气充分反应;再称量反应后金属粉末的质量;最后通过密度公式求氧气的体积.
点评:本题主要考查高锰酸钾制取氧气的反应原理、注意事项,气体的体积的测量,同时也考查了空气中氧气含量的测定,本题通过实验资料和实验分析,得到了正确的结论,同学们要结合题意具体分析,综合掌握.

 K2MnO4+MnO2+O2↑;通过排水量来测定所收集到氧气的体积,整套实验装置接口的正确连接顺序为a→f→e→g;
K2MnO4+MnO2+O2↑;通过排水量来测定所收集到氧气的体积,整套实验装置接口的正确连接顺序为a→f→e→g; K2MnO4+MnO2+O2↑; f→e→g;
K2MnO4+MnO2+O2↑; f→e→g;


 (2012?临沂模拟)某研究性学习小组选择从空气中制取氮气作为研究课题,如图是他们设计的实验方案,请回答问题:
(2012?临沂模拟)某研究性学习小组选择从空气中制取氮气作为研究课题,如图是他们设计的实验方案,请回答问题: