
 CaO+CO2↑ 氧化钙与水反应放出大量的热,容易灼伤人 MgSO4+Ca(OH)2═CaSO4+Mg(OH)2↓ Mg(OH)2+2HCl═MgCl2+2H2O 氯气可以用来制盐酸节省原料
CaO+CO2↑ 氧化钙与水反应放出大量的热,容易灼伤人 MgSO4+Ca(OH)2═CaSO4+Mg(OH)2↓ Mg(OH)2+2HCl═MgCl2+2H2O 氯气可以用来制盐酸节省原料 CaO+CO2↑;氧化钙与水反应放出大量的热,容易灼伤人;MgSO4+Ca(OH)2═CaSO4+Mg(OH)2↓;Mg(OH)2+2HCl═MgCl2+2H2O;氯气可以用来制盐酸节省原料.
CaO+CO2↑;氧化钙与水反应放出大量的热,容易灼伤人;MgSO4+Ca(OH)2═CaSO4+Mg(OH)2↓;Mg(OH)2+2HCl═MgCl2+2H2O;氯气可以用来制盐酸节省原料.

 口算题天天练系列答案
口算题天天练系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
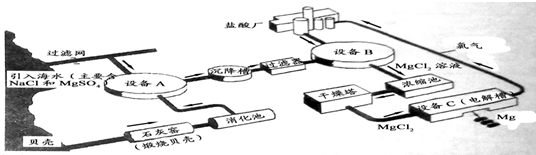
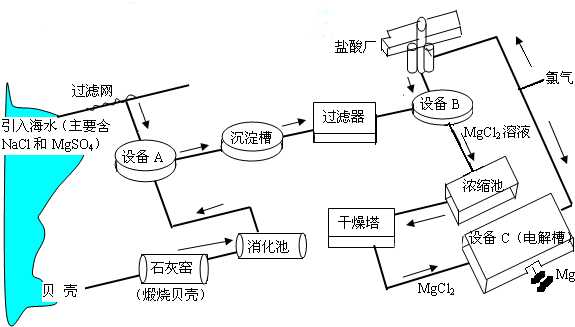
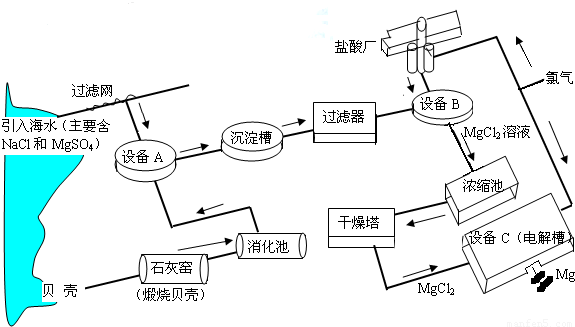
海水中镁的含量一般为1.28g?L-1,总储量约为2×1015t某镁冶炼厂利用海水制镁,其工业流程如下:
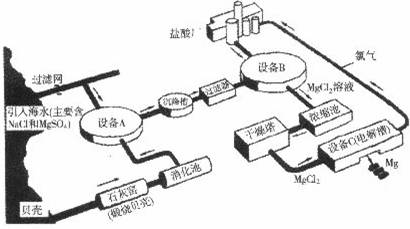
根据上述流程图,回答下列问题:
(1)石灰窑中发生反应的化学方程式为 。
(2)消化池中发生的反应CaO +H2O=====Ca(OH)2,其反应类型为 ,
消化池中温度升高的原因是 。
(3)写出设备A、B和C中反应的化学方程式
A: ;
B: ;
C: 。
⑷氯气不能排放到空气中,而要循环使用,其原因是:
①氯气有毒,排入空气会污染环境;
② 。
查看答案和解析>>
科目:初中化学 来源:2008年山东省潍坊市中考化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com