
 为测定锌铜合金中锌的含量,取该合金放入如图 盛有稀硫酸的锥形瓶中,多次实验后,取平均值所得数据如下表:
为测定锌铜合金中锌的含量,取该合金放入如图 盛有稀硫酸的锥形瓶中,多次实验后,取平均值所得数据如下表:| 反应前 | 充分反应后装置及反应剩余物质质量 | |
| 装置和足量的稀硫酸质量 | 锌铜合金质量 | |
| 342.10g | 16.00 | 357.70g |
分析 铜不能和稀硫酸反应,锌和稀硫酸反应生成硫酸锌和氢气,反应前后的质量差即为反应生成氢气的质量,根据氢气的质量可以计算锌的质量,进一步可以计算该合金中锌的质量分数.
解答 解:(1)设锌的质量为x,
反应生成氢气的质量为:342.10g+16.00g-357.70g=0.4g,
Zn+H2SO4═ZnSO4+H2↑,
65 2
x 0.4g
$\frac{65}{x}$=$\frac{2}{0.4g}$,
x=13g,
该合金中锌的质量分数为:$\frac{13g}{16.00g}$×100%=81.25%,
答:该合金中锌的质量分数为81.25%.
(2)如没有干燥装置,部分水蒸气会随着氢气逸出,导致计算结果会偏大.
故填:偏大.
点评 计算生成氢气的质量时利用了差量法,差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
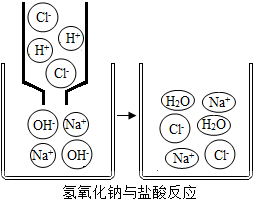 今有①肥皂水 ②食盐水 ③杨梅汁 ④白糖水 ⑤蒸馏水,5种液体,根据你的生活经验判断,其中pH<7的是③,pH>7的是①,pH=7的是②④⑤(填序号).右图是氢氧化钠与盐酸反应的微观示意图,请仔细观察、分析此图,写出一条你从图中获取的信息(用文字或化学用语表述)氢氧化钠与盐酸反应的实质是氢离子与氢氧根离子反应生成水.
今有①肥皂水 ②食盐水 ③杨梅汁 ④白糖水 ⑤蒸馏水,5种液体,根据你的生活经验判断,其中pH<7的是③,pH>7的是①,pH=7的是②④⑤(填序号).右图是氢氧化钠与盐酸反应的微观示意图,请仔细观察、分析此图,写出一条你从图中获取的信息(用文字或化学用语表述)氢氧化钠与盐酸反应的实质是氢离子与氢氧根离子反应生成水.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com