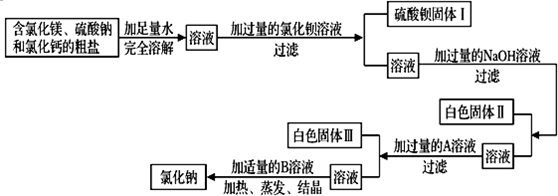
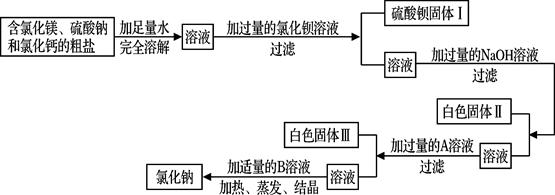
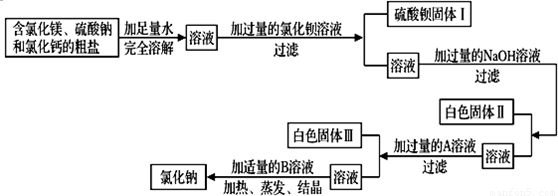
解:(1)海水中含量最多的化学物质是水,其次是氯化钠;从海水中提取盐最常用的方法是蒸发;
故答案为:氯化钠; 蒸发.
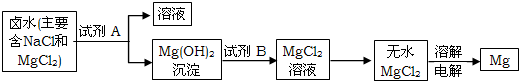
(2)①试剂A与海水中的氯化镁反应生成了氢氧化镁沉淀,则试剂A中的溶质一定是一种碱,以贝壳(主要成分是碳酸钙)为原料制取的碱为氢氧化钙,所以试剂A中的溶质是Ca(OH)
2;氯化镁与氢氧化钙反应生成氯化钙和氢氧化镁沉淀,故方程式为:MgCl
2+Ca(OH)
2═CaCl
2+Mg(OH)
2↓;
故答案为:Ca(OH)
2;MgCl
2+Ca(OH)
2═CaCl
2+Mg(OH)
2↓.
②过滤是分离液体与不溶于液体的固体的方法,所用玻璃仪器有:烧杯、漏斗、玻璃棒;
故答案为:玻璃棒;漏斗.
③试剂B是用来溶解沉淀氢氧化镁的,以及最后得到的氯化镁可知试剂B为稀盐酸;由无水MgCl
2制取Mg的反应类型为分解反应.
故答案为:稀盐酸;分解反应.
(3)根据信息:利用氯化钠和水在通电条件下生成烧碱、氢气和氯气.可知反应物是氯化钠和水,反应条件是通电,生成烧碱、氢气和氯气,所以化学反应式是:2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑.
故答案为:2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑.
分析:(1)根据海水的成分及获得粗盐的方法即可作答;
(2)根据生成氢氧化镁沉淀必须在海水中加碱溶液,由贝壳制得的碱只能是氢氧化钙回答A溶液中的溶质;根据氯化镁与氢氧化钙反应生成氯化钙和氢氧化镁沉淀书写方程式;
②、根据过滤所用仪器分析;
③根据试剂B是用来溶解沉淀氢氧化镁的,以及最后得到的氯化镁进行分析;
(3)根据信息:利用氯化钠和水在通电条件下生成烧碱、氢气和氯气.写出化学反应式.
点评:海洋是人类巨大的自然宝库,不单是自然界中最大的储水库,还蕴藏着丰富的化学资源.了解过滤的原理和使用仪器,掌握氯化镁、盐酸、氢氧化镁等物质的化学性质是解题的关键点.

 2NaOH+H2↑+Cl2↑.
2NaOH+H2↑+Cl2↑. 2NaOH+H2↑+Cl2↑.
2NaOH+H2↑+Cl2↑.