
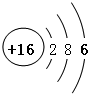
 ;11号是钠元素,钠原子结构示意图为
;11号是钠元素,钠原子结构示意图为 ;钠元素的原子易失去1个电子,带1个正电荷;硫元素的原子易得2个电子,带2个负电荷,故原子序数为11、16的元素组成化合物的化学式:Na2S.
;钠元素的原子易失去1个电子,带1个正电荷;硫元素的原子易得2个电子,带2个负电荷,故原子序数为11、16的元素组成化合物的化学式:Na2S.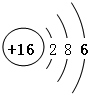 ;
;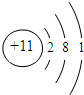 ;Na2S.
;Na2S.

科目:初中化学 来源: 题型:
 16、元素周期表是学习和研究化学的重要工具.请完成下列问题:
16、元素周期表是学习和研究化学的重要工具.请完成下列问题:

查看答案和解析>>
科目:初中化学 来源: 题型:





查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com