
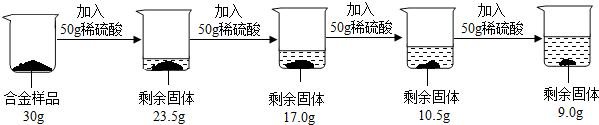
(5分)某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品30g放入烧杯中,然后将200g溶质质量分数为19.6%的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应。实验数据如下:

请计算:
(1)该合金中铜的质量分数为 。
(2)该合金组成中除铜外,另一种金属是什么?(必须写出计算推理过程)
(3)计算第三次加入稀硫酸充分反应后,所得溶液以及其中溶质的质量分别为多少?
(1)30%·······················1分
(2)解:设另一种金属为M,相对原子质量为X。
M + H2SO4 = MSO4 + H2↑
X 98
6.5g 50g×19.6%
X=65
所以该金属是锌。····················1分
(3)解:设第三次反应后生成硫酸锌的质量为Y,氢气质量为Z。
Zn + H2SO4=ZnSO4+H2↑
98 161 2
50g×3×19.6% Y Z
Y=48.3g Z=0.6g·························1分
所以溶质ZnSO4的质量为48.3g,而溶液的质量为:19.5 g + 150 g - 0.6 g = 168.9 g(1分)
【解析】(1)由图片可以看出:前三次各加50g稀硫酸,固体质量都减少了6.5g,而第四次加50g,固体质量只减少(10.5g-9.0g)=1.5g,说明金属锌或镁已经反应完了,剩余9.0g固体为铜,则该合金中铜的质量分数为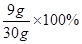 =30% 。
=30% 。
(2)可根据化学方程式进行计算,计算出金属的相对原子质量,就可以推断出是哪种金属。计算如下:解:设另一种金属为M,相对原子质量为X。
M + H2SO4 = MSO4 + H2↑
X 98
6.5g 50g×19.6%
X=65
所以该金属是锌。
(3) 第三次加入稀硫酸充分反应后, 溶液的质量应为三次所加稀硫酸的质量(50g×3)加上溶进去的金属质量(30g-10.5g)再减去生成氢气的质量。根据化学方程式进行计算,将计算结果代入即可。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:初中化学 来源: 题型:
| 编 号 | 1 | 2 | 3 | 4 |
| 加入硫酸的质量/g | 14 | 14 | 14 | 14 |
| 剩余固体的质量/g | 8.7 | 7.4 | 6.1 | 6.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源:平谷区 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com