
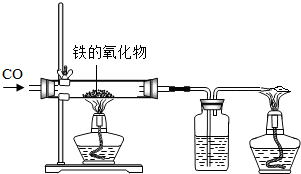
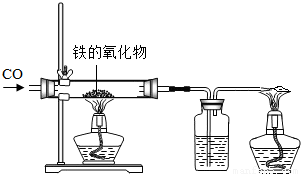
 (1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入CO并加热,使铁的氧化物与足量的CO充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为______;实验完毕称得洗气瓶的质量增加了______g.
(1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入CO并加热,使铁的氧化物与足量的CO充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为______;实验完毕称得洗气瓶的质量增加了______g. =
= ,即氧化物的化学式为Fe3O4.
,即氧化物的化学式为Fe3O4. 3Fe+4CO2
3Fe+4CO2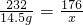 x=11g
x=11g 2CO2
2CO2 m=1.6g
m=1.6g 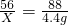 X=2.8g
X=2.8g 2H2O
2H2O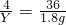 Y=0.2g
Y=0.2g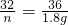 n=1.6g
n=1.6g 

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
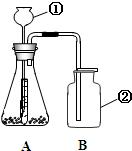 24、小红用下图装置制取二氧化碳,请完成下列问题:
24、小红用下图装置制取二氧化碳,请完成下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
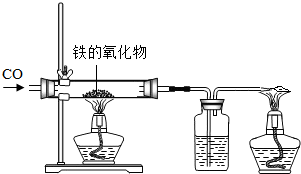 (1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入CO并加热,使铁的氧化物与足量的CO充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为
(1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入CO并加热,使铁的氧化物与足量的CO充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为查看答案和解析>>
科目:初中化学 来源:专项题 题型:计算题
查看答案和解析>>
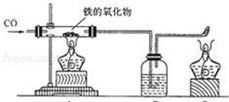
科目:初中化学 来源:2008年广东省茂名市高州市“缅茄杯”学科竞赛试卷(初三化学)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com