
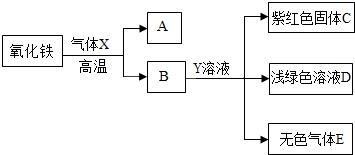
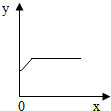
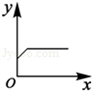
| 选项 | x | y |
| A. | 铁粉质量 | 溶液质量 |
| B. | 铁粉质量 | 析出铜的质量 |
| C. | 反应时间 | 生成硫酸亚铁的质量 |
| D. | 反应时间 | 反应过程中金属质量的变化情况 |
| ||
| ||


科目:初中化学 来源: 题型:阅读理解
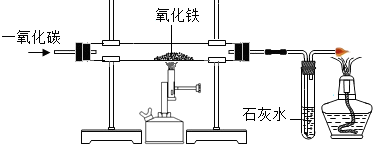 铁、铝、铜是日常生活中使用最广泛的金属.
铁、铝、铜是日常生活中使用最广泛的金属.| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g?cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
| ||
| ||
| ||
| ||
| ||
| 64×2 |
| 64×2+32 |
| 64×2 |
| 64×2+32 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


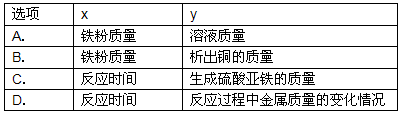
| 选项 | x | y |
| A. | 铁粉质量 | 溶液质量 |
| B. | 铁粉质量 | 析出铜的质量 |
| C. | 反应时间 | 生成硫酸亚铁的质量 |
| D. | 反应时间 | 反应过程中金属质量的变化情况 |
查看答案和解析>>
科目:初中化学 来源:专项题 题型:填空题
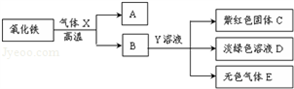
①写出气体X与氧化铁反应的化学方程式 _________ .
②Y溶液中的溶质为 _________ .
③写出生成无色气体E的化学方程式 _________ .
(4)根据铁与硫酸铜溶液的反应判断,下表中x和y所表示的四种关系符合如图变化规律的是 _________ (填序号).
查看答案和解析>>
科目:初中化学 来源:2011年北京市石景山区中考化学二模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com