
| 实验序号 | 实验过程 | 实验现象 |
| 1 | 镁粉和铁粉分别与5%盐酸反应 | 镁粉产生气体快 |
| 2 | 铁粉和铁片分别与10%盐酸反应 | 铁粉产生气体快 |
| 3 | 铁片分别与5%盐酸和10%盐酸反应 | 10%盐酸产生气体快 |


科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
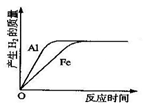
| A.铝粉、铁粉和硫酸反应后均有剩余 |
| B.铝粉、铁粉均反应完,硫酸有剩余 |
| C.硫酸、铁粉均反应完,铝粉有剩余 |
| D.硫酸、铝粉均反应完,铁粉有剩余 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
 SiO2+Ti。你认为该反应的类型是 ( )
SiO2+Ti。你认为该反应的类型是 ( )| A.化合反应 | B.分解反应 | C.置换反应 | D.无法确定 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| 颜色、状态 | 硬度 | 密度 | 熔点 | 延展性 | 导电、导热 | 耐腐蚀 |
| 银白色固体 | 较硬 | 4.5g/cm3 | 高 | 好 | 好 | 好 |
| 你的猜想 | 验证方法 | 现象 | 结论 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com