25.(2008?沈阳)一化学小组为了测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.称取该铜矿样品30g于烧杯中,逐滴滴入132.2g稀盐酸至刚好完全反应,生成CO2气体4.4g(假设铜矿中的杂质不与稀盐酸反应,也不溶于水)试求:
(1)铜矿中碱式碳酸铜的质量是多少克?其质量分数是多少?
(2)反应后所得氯化铜溶液中溶质的质量分数是多少?
(反应的化学方程式为:Cu2(OH)2CO3+4HCl═2CuCl2+CO2↑+3H2O.)
【答案】
分析:铜矿中碱式碳酸铜质量分数=

,因此需要计算样品中碱式碳酸铜的质量;反应后所得氯化铜溶液中溶质的质量分数=

,因此需要计算生成氯化铜的质量及反应后溶液的质量;
铜矿中碱式碳酸铜与滴入的盐酸反应,生成氯化铜、水和二氧化碳;根据反应的化学方程式,由生成二氧化碳气体的质量可计算参加反应的铜矿中碱式碳酸铜的质量及生成的氯化铜的质量;反应后溶液质量可利用质量守恒定律解决.
解答:解:设铜矿中碱式碳酸铜的质量是为x,生成氯化铜的质量为y.
Cu
2(OH)
2CO
3+4HCl=2CuCl
2+3H
2O+CO
2↑
222 270 44
x y 4.4g
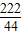
=
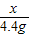
x=22.2g
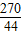
=
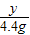
y=27g
铜矿样品中碱式碳酸铜的质量分数为
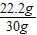
×100%=74%
反应后所得氯化铜溶液的质量为22.2g+132.2g-4.4g=150g
反应后所得氯化铜溶液中溶质的质量分数为
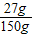
×100%=18%
答:(1)铜矿样品中碱式碳酸铜的质量是22.2g,其质量分数是74%;
(2)反应后所得氯化铜溶液中溶质的质量分数是18%.
点评:反应后溶液的质量,根据质量守恒定律,反应后所得溶液质量=参加反应的铜矿样品中碱式碳酸铜的质量+所加盐酸质量-放出气体二氧化碳的质量,使溶液质量的计算简便明了.

 ,因此需要计算样品中碱式碳酸铜的质量;反应后所得氯化铜溶液中溶质的质量分数=
,因此需要计算样品中碱式碳酸铜的质量;反应后所得氯化铜溶液中溶质的质量分数= ,因此需要计算生成氯化铜的质量及反应后溶液的质量;
,因此需要计算生成氯化铜的质量及反应后溶液的质量;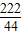 =
=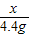 x=22.2g
x=22.2g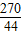 =
=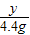 y=27g
y=27g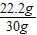 ×100%=74%
×100%=74%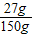 ×100%=18%
×100%=18%


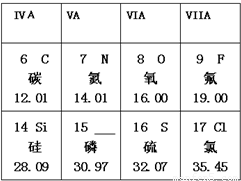
 相似的物质的化学式.
相似的物质的化学式.