
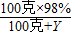 ×100%=20%,解得Y=390克,所以需要蒸馏水的体积是390毫升;稀释时需要在烧杯中进行,用玻璃棒进行搅拌,所以用到烧杯和玻璃棒;稀释时将浓硫酸沿着容器壁慢慢倒入水中,并用玻璃棒搅拌使溶解时放出的热量及时的散放出去;
×100%=20%,解得Y=390克,所以需要蒸馏水的体积是390毫升;稀释时需要在烧杯中进行,用玻璃棒进行搅拌,所以用到烧杯和玻璃棒;稀释时将浓硫酸沿着容器壁慢慢倒入水中,并用玻璃棒搅拌使溶解时放出的热量及时的散放出去;

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com