
【题目】以下是初中化学常见实验,请回答有关问题。
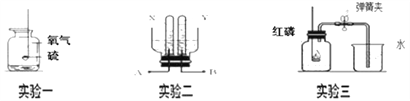
(1)实验一的集气瓶中预先加入少量水,其作用是_____;
(2)实验二为电解水的实验,其中 A 是与电源的_____极相连。实验开始时, X 和 Y 气体的体积比 大于 2:1,其可能原因是:_____(填序号);
①氧气溶解的更多 ②氢气溶解的更多 ③氧气的密度大 ④氢气的密度小
(3)实验三是测定空气中的氧气含量,假如集气瓶容积为 100mL,实验前已装水 20mL,则流进集气瓶内的水约是_____mL。该实验成功的关键是_____(填序号)。
①该装置气密性好 ②实验前夹紧止水夹 ③红磷过量或足量
④冷却后再打开止水夹 ⑤要选用教室内的空气 ⑥要将红磷慢慢伸入集气瓶中
【答案】 吸收二氧化硫,减少空气污染 负 ① 16 ①②③④
【解析】(1)硫燃烧生成二氧化硫污染空气,集气瓶中预先加入了少量水,其作用是吸收二氧化硫,污染空气;(2)该实验中用到的电源是直流电,与气体A相连产生的气体较多,所以是电源的负极,产生的是氢气;由于氧气的溶解性比氢气的大.所以,实验刚开始时,X和Y气体的体积比>2:1;(3)由于空气中氧气约占空气体积的![]() ,集气瓶容积为120mL,实验前已经装水20mL,剩余空气的体积是100mL,白磷燃烧消耗了氧气,等冷却后进入集气瓶的水约为20mL;该实验成功的关键因素是:装置气密性好、实验前夹紧止水夹、红磷过量或足量、冷却后再打开止水夹,选用实验室内的空气不是实验成功的关键。
,集气瓶容积为120mL,实验前已经装水20mL,剩余空气的体积是100mL,白磷燃烧消耗了氧气,等冷却后进入集气瓶的水约为20mL;该实验成功的关键因素是:装置气密性好、实验前夹紧止水夹、红磷过量或足量、冷却后再打开止水夹,选用实验室内的空气不是实验成功的关键。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:初中化学 来源: 题型:
【题目】CaCO3在生产生活中有广泛的用途.
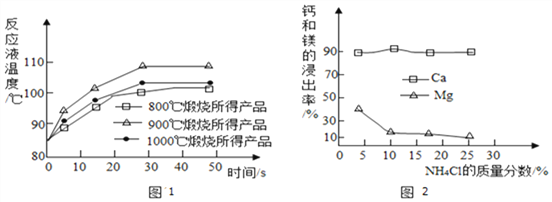
(1)煅烧石灰石可制得活性CaO,反应的化学方程式为___________。为测定不同煅烧温度对CaO活性的影响,某化学兴趣小组进行了如下实验:
Ⅰ.取石灰石样品分为三等份,在同一设备中分别于800℃、900 ℃和1000℃条件下煅烧;
Ⅱ.所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示。上述温度中,___________℃时煅烧所得CaO活性最高。
(2)以电石渣(主要成分为Ca(OH)2,还含有少量MgO等杂质)为原料制备高纯活性CaCO3的流程如图3。(资料:氨水的pH约为11.7,氢氧化镁完全沉淀的pH约为10.87)
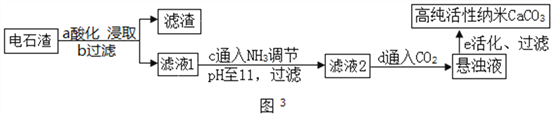
①步骤a中加入的药品为NH4Cl溶液,由此说明NH4Cl溶液呈________性(填酸性、中性或碱性);如图2为浓度对钙、镁元素浸出率的影响。由图可知NH4Cl溶液的质量分数达到10%以上主要溶解的是Ca(OH)2;浸取时主要发生反应的化学方程式为_________________。
②流程c通入NH3的目的主要有两个,一是调节溶液的pH值,二是_______。
③滤液1中通入NH3和CO2后生成碳酸钙和氯化铵,写出发生反应的化学方程式为________________。
④向滤液1中滴加Na2CO3溶液,也能得到CaCO3,从节约药品角度分析图3所示流程中可循环利用的物质有__________________(写出两种物质)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将4.0g Cu-Zn合金粉末放到盛有10g稀硫酸的烧杯中,恰好完全反应。过滤、称量滤液的质量。相关实验数据如下:
反应前物质的质量/g | 反应后物质的质量/g | |
Cu-Zn合金 | 稀硫酸 | 固体和液体的总质量 |
4.0 | 10 | 13.96 |
若不考虑该合金中除Cu、Zn以外的其他成分,请计算
(1)原Cu-Zn合金中Zn的质量为___________。
(2)所用稀硫酸中溶质的质量分数为___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为海水吸收CO2并进行碳循环的原理示意图。回答下列问题:
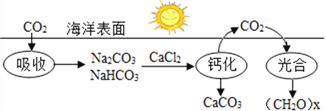
(1)“光合”作用中太阳能转化为_________。
(2)写出“钙化”中发生的两个反应的化学方程式:a.__________; b.__________。
(3)此循环过程中吸收的CO2与“钙化”中释放的CO2的质量关系是_________________(填“大于”、“小于”或“等于”)。
(4)此碳循环中将CO2转化为(CH2O)x属于_______(填“无机物”或“有机物”),同时生成的一种无机物是_______。此碳循环过程的优点是_______(写出一点即可)。
(5)工业上从海水中可提取许多广泛应用于生活、生产、科技等方面的物质和原料。
Ⅰ.从海水中获得淡水。下列方法常用于海水淡化的是_________(填字母)。
A.蒸馏法 B.吸附法 C.沉淀法 D.过滤法
Ⅱ.从海水中提取溴(Br2)。工业上通常是将氯气通入海水晒盐后的母液中,将溶液中的溴化钠(NaBr)转化为溴单质(Br2),然后鼓入热空气,使溴单质(Br2)从溶液中挥发出来,冷凝后得到粗溴。其中主要反应的化学方程式为______,其基本反应类型是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】粗盐中含有MgCl2、CaCl2等杂质,必须进行分离和提纯后才能用于工业生产和人们的日常生活。粗盐提纯的部分流程如图:请回答:
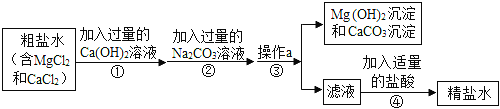
(1)写出步骤①中所发生的化学反应___________。
(2)步骤②加入过量的碳酸钠溶液的目的是什么_________________?
(3)步骤④获得精盐水后,通过什么操作得到食盐晶体________________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】回答与水有关的问题。
①保持水的化学性质的最小粒子是_____________。②生活中可以用_________来区分硬水和软水。③家用环保型净水器中装有活性炭,活性炭起______________作用。④电影《火星救援》中马特·达蒙用液态的火箭燃料联氨(N2H4)在密闭容器中高温分解生成氮气、氢气和氨气(NH3),然后利用分解出的氢气燃烧制取水,解决了火星上缺少液态水的问题。请写出联氨(N2H4)分解的化学方程式___________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钾的溶解度曲线如图所示。下列说法正确的是
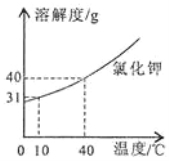
A.升高温度可使接近饱和的氯化钾溶液变为饱和溶液
B.10℃时,65.5g氯化钾的饱和溶液中加入5g氯化钾,充分溶解后将温度升高到40℃,得到70g氯化钾饱和溶液
C.50g水中加入20g氯化钾充分溶解,形成氯化钾饱和溶液
D.40℃时,氯化钾饱和溶液中溶质的质量分数为40%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水及溶液与人类的生活生产密切相关。根据下列图示,请回答相关问题。
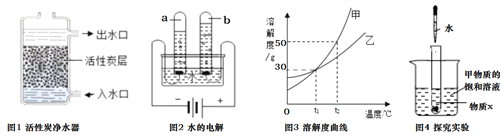
(1)图1中,活性炭净水器主要利用了活性炭具有的_______性;图2所示实验中,试管b中得到的气体是(写物质名称)_______。
②图3为甲、乙两种固体物质的溶解度曲线图。t1℃时,甲物质的溶解度是_________,t2℃时,甲的饱和溶液溶质质量分数_________乙的饱和溶液溶质质量分数(填“大于”、“等于”、“小于”之一);图4所示实验中,将水滴入盛有物质X的小试管中,可观察到烧杯中有甲物质的固体析出。则物质X可能是_________(填序号之一)。
A.食盐 B.烧碱 C.生石灰 D.硝酸铵
(3)海水中蕴着丰富的物物质资源。
①我国海盐年产量居世界第一位。目前从海水中提取食盐的方法主要为“盐田法”,生产流程如下图所示:
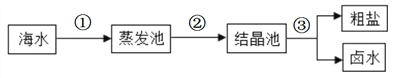
在蒸发池中促进水分蒸发,主要是利用了_________(填序号之一)。
A.潮沙汐能 B,生物能 C.电能 D.太阳能
上述流程中得到的卤水,是氯化钠的________溶液(填“饱和”或“不饱和”)。
②金属镁广泛应用于生活、生产和国防工业,从海水或卤水中提取镁的工艺流程如下图所示:
![]()
在上述转化过程,步骤①得到氢氧化镁固体的操作名称是___________,步骤②中发生反应的化学方程式为____________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下表是不同温度时硝酸钾的溶解度,有关说法正确的是( )
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/克 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
A. 20℃时,100克硝酸钾饱和溶液中含硝酸钾31.6克
B. 40℃时硝酸钾饱和溶液中,溶质硝酸钾的质量分数为63.9%
C. 100℃的水能溶解的硝酸钾一定比80℃的水能溶解的硝酸钾多
D. 100℃时(100+246)克硝酸钾饱和溶液降温到60℃时,析出硝酸钾固体的质量为136克
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com