
 “双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.同学们对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究.
“双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.同学们对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究.| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品放入试管中,滴加一定量的 稀盐酸,用带导管的单孔橡皮塞塞紧试管口,导管另一端伸入澄清石灰水中 | 试管中固体逐渐溶解,有大量气泡产生,得到浅绿色溶液,澄清石灰水变浑浊. | 样品中一定含有 Fe、CaCO3, 不含Fe2O3. |
| ②取少量样品放入试管中,加水,静置向上层清液中滴加无色酚酞试液 | 放出大量的热量,试管底部有不溶物,酚酞试液由无色变为红色. | 样品中含有 氧化钙或氢氧化钙或二者都有. |

分析 【实验探究1】从实验现象产生的原因去分析解答;
【实验质疑】从实验结论中的物质加水后发生的反应去分析解答;
【实验探究2】(1)过滤可以将固体与液体分开;
(2)根据方程式的质量比分析;
(3)氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠;
(4)从每一过程中剩余的物质及物质发生的反应去分析解答;
【实验反思】
A、对物质成分的探究有时需要定性与定量实验的结合;
B、从加入的是过量的碳酸钠溶液,因此里面的溶质还有Na2CO3去分析解答;
C、从实验探究1、2实验中生成的气体成分去分析解答;
D、从久置“双吸剂”固体的成分去分析解答.
解答 解:【实验探究1】由题目中可知固体成分可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3,由表中实验现象:“试管中固体逐渐减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊.”说明固体和一种物质反应生成了二氧化碳气体(澄清石灰水变浊的气体),和一种含有Fe2+的物质(得到浅绿色溶液),实验室里制取二氧化碳气体的方法为用石灰石和稀盐酸反应,其化学方程式式为:CaCO3+2HCl═CaCl2+H2O+CO2↑,而铁也可以和稀盐酸反应生成氯化亚铁和氢气,其化学方程式为:Fe+2HCl═FeCl2+H2↑,可以推出加入的这种物质为稀盐酸,固体物质中一定有的物质是Fe和CaCO3;其他的固体物质中可以和稀盐酸反应的有:①氧化钙和盐酸反应生成氯化钙(溶液为无色)和水,其反应化学方程式为:CaO+2HCl═CaCl2+H2O;②氢氧化钙和盐酸反应生成氯化钙(溶液为无色)和水,其反应的化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;③氧化铁和盐酸反应生成氯化铁(溶液为黄色)和水,其反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O.由于最后所得溶液没有显黄色,也就是溶液中没有,所以固体物质中一定没有Fe2O3.
故答案为:稀盐酸;Fe和CaCO3;
加水溶解后,氧化钙可和和水反应生成氢氧化钙,同时反应放出大量的热,生成的氢氧化钙的溶液呈碱性,能使无色的酚酞试液变成红色;
故答案为:氧化钙或氢氧化钙或二者都有;
【实验质疑】由于氧化铁和盐酸反应生成的氯化铁,可能会继续与铁反应生成氯化亚铁;
故答案为:Fe2O3+6HCl═2FeCl3+3H2O;Fe+2FeCl3=3FeCl2;
【实验探究2】(1)过滤可以将固体与液体分开,故答案为:过滤;
(2)取3g样品研碎,并用磁铁充分吸引后,得到剩余固体2.6g,所以已经出去了铁粉,溶解过滤的固体Ⅰ的质量为2g,其中含有碳酸钙还可能有氧化铁,由碳酸钙与盐酸反应方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑;
100 44
由于生成气体0.44g所以固体Ⅰ中含有1g碳酸钙,所以固体Ⅰ中含有碳酸钙和氧化铁,
故答案为:CaCO3和Fe2O3
(3)氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
故答案为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
(4)确定固体E是否洗涤干净的方法是:取最后一次洗涤液加BaCl2或CaCl2或稀盐酸或无色酚酞试液等,如无现象,则已洗净;
【反思与评价】
A、对物质成分的探究有时需要定性与定量实验的结合;故A正确;
B、由分析中可知实验中氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,溶质有NaOH,由于加入的是过量的碳酸钠溶液,因此里面的溶质还有Na2CO3,故B正确;
C、由实验探究1可知实验中产生的气体为氢气和二氧化碳气体两种,由实验探究2可知实验中产生的气体为二氧化碳气体所以生成的气体成分不同;故C正确;
D、由固体物质的成分为:Fe、Fe2O3、CaO、Ca(OH)2、CaCO3;最起码五种物质都与盐酸反应,反应个数多于5个;故D错误;
故答案为:D
答案:
【实验探究1】
稀盐酸; Fe、CaCO3;氧化钙或氢氧化钙或二者都有;
【实验质疑】
Fe2O3+6HCl═2FeCl3+3H2O; Fe+2FeCl3═3FeCl2;
【实验探究2】
(1)过滤;
(2)CaCO3、Fe2O3
(3)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;向上层清夜中加Na2CO3溶液(或碳酸钾溶液),若无沉淀生成,则已过量;
(4)加BaCl2或CaCl2或稀盐酸或无色酚酞试液等,如无现象,则已洗净(合理即可)
(5)D
点评 本考点既考查了实验步骤的设计,又考查了化学方程式的书写,还对实验进行了评价,综合性比较强.实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究.同学们要具体分析,综合掌握.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 从一个元素符号图片你可以获得的信息是:(以铁为例)元素名称铁;元素的种类金属元素;元素符号Fe;相对原子质量55.85;原子序数26;原子核电荷数26.
从一个元素符号图片你可以获得的信息是:(以铁为例)元素名称铁;元素的种类金属元素;元素符号Fe;相对原子质量55.85;原子序数26;原子核电荷数26.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物质与氧气发生的反应是化合反应 | |
| B. | 物质与氧气发生的反应都能产生燃烧现象 | |
| C. | 物质与氧气发生的反应是氧化反应 | |
| D. | 只有物质与氧气发生的反应才是氧化反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 符号 | 符号的意义 | 符号中“2”的意义 |
| O2- | 氧离子 | 一个氧离子带有2个单位的负电荷 |
| 2O | 2个氧原子 | 氧原子的个数是2 |
| O2 | 氧气 | 一个氧分子中含有2个氧原子 |
| H2O | 水 | 一个水分子中含有2个氢原子 |
| 2HCl | 2个氯化氢分子 | 氯化氢分子的个数为2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
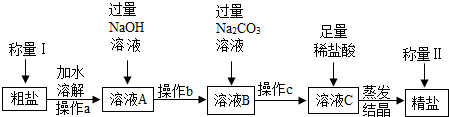
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
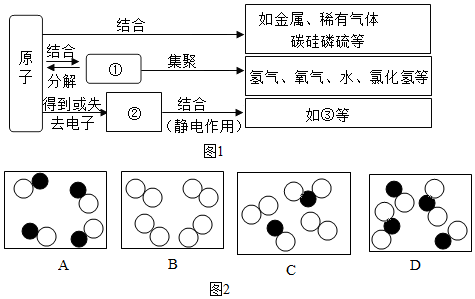
 ”表示不同元素的原子,图2微观示意图能表示化合物的是A.
”表示不同元素的原子,图2微观示意图能表示化合物的是A.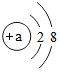
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com