
 ×100%,溶液的质量等于溶质质量和溶剂质量之和,生石灰和水反应生成氢氧化钙,放出热量,氢氧化钙微溶于水,据此分析判断.
×100%,溶液的质量等于溶质质量和溶剂质量之和,生石灰和水反应生成氢氧化钙,放出热量,氢氧化钙微溶于水,据此分析判断.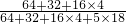 ×100%=1.28g,形成的硫酸铜溶液的质量是100g,生石灰和水发生反应生成氢氧化钙,溶液中溶质是氢氧化钙,而Ca(OH)2微溶于水(<0.1g),因此所得溶液中溶质的质量分数最小的是B;
×100%=1.28g,形成的硫酸铜溶液的质量是100g,生石灰和水发生反应生成氢氧化钙,溶液中溶质是氢氧化钙,而Ca(OH)2微溶于水(<0.1g),因此所得溶液中溶质的质量分数最小的是B;

科目:初中化学 来源: 题型:阅读理解

| 猜想 | 简单实验方案 | 现象 | CO和CuO反应的化学方程式 |
| 粉末为Cu | 不反应 | CuO+CO=Cu+CO2 | |
| 粉末溶解,溶液变成蓝色,生成红色粉末 | 2CuO+CO=Cu2O+CO2 |

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 选项 | A | B | C | D |
| 物质 | 橘子 | 泡菜 | 葡萄 | 玉米粥 |
| pH | 2.9~3.5 | 3.0~4.0 | 3.5~4.5 | 6.8-8.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 下列数据是硝酸钾和氯化钠在不同温度时的溶解度.
下列数据是硝酸钾和氯化钠在不同温度时的溶解度.| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 硝酸钾/克 | 13.3 | 31.6 | 63.9 | 110 | 169 |
| 氯化钠/克 | 35.7 | 35.9 | 36.4 | 37.1 | 38 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g/100g水) |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (1)碘酒溶液中溶质是
(1)碘酒溶液中溶质是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com