
【题目】工业上粗盐(含MgCl2、CaCl2、Na2SO4等杂质),精制的工艺流程如下:
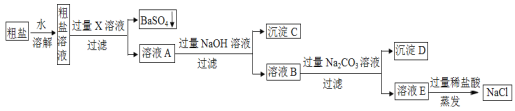
(1)X中含有的阳离子是________________;沉淀C的化学式是_____________。
(2)写出生成沉淀D的一个化学方程式_______________________________________。
(3)溶液E中加过量稀盐酸的作用是________________________________________。
【答案】Ba2+ Mg(OH)2 CaCl2+Na2CO3=CaCO3↓+2NaCl或BaCl2+Na2CO3=BaCO3↓+2NaCl 除尽过量的Na2CO3
【解析】
工业上粗盐(含MgCl2、CaCl2、Na2SO4等杂质)的精制实际上是除去镁离子、钙离子、硫酸根离子的过程。
(1)粗盐中含有MgCl2、CaCl2、Na2SO4等杂质,所以X中含有的阳离子是Ba2+,X是氯化钡溶液,加入过量的X生成了硫酸钡沉淀;溶液A中含有镁离子,氢氧根离子和镁离子会生成氢氧化镁沉淀,所以沉淀C的化学式是Mg(OH)2;
(2)碳酸根离子和钙离子、钡离子会生成碳酸钙沉淀、碳酸钡沉淀,所以生成沉淀D的化学方程式是:CaCl2+Na2CO3=CaCO3↓+2NaCl或BaCl2+Na2CO3=BaCO3↓+2NaCl;
(3)加入的过量的碳酸钠和氢氧化钠对于氯化钠也是杂质,所以溶液E中加过量稀盐酸的作用是:除尽过量的碳酸钠和氢氧化钠。


科目:初中化学 来源: 题型:
【题目】某工业废水含有大量FeSO4,少量Ag+及污泥。某同学设计了以下流程回收Ag和FeSO47H2O晶体。

(1)FeSO4中S的化合价为_____,2个银原子用化学符号表示为_____。
(2)步骤①中,经过滤得到污泥和溶液1.过滤需要的玻璃仪器有_____、_____和玻璃棒,玻璃棒的作用是_____。
(3)步骤②中:需加入的物质是_____,分离所得混合物的方法是_____。
(4)步骤③中:需加入的物质是_____,发生反应的化学方程式是_____。
(5)某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合理?_____,理由是_____。
(6)溶液2和溶液3合并的目的是_____、_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定空气中氧气的体积分数,小花同学按图甲所示的装置进行了多次实验,发现每次测得的氧气体积分数总是远小于21%,他认为误差主要由实验装置造成,于是改用图乙装置进行实验。
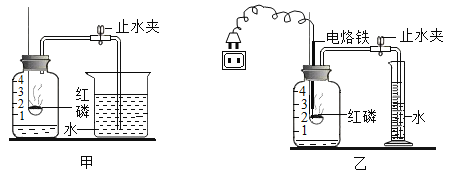
①小花按如甲装置进行实验时,该如何检查装置的气密性_____。
②与装置甲相比,装置乙可以减小实验误差,其原因是_____。
③小强同学按图1所示装置测定空气中氧气的含量,并用压强传感器实时地传回集气瓶内压强一时间关系图(该装置气密性良好,P0是集气瓶内初始气压,P1和P2分别是反应结束后恢复到室温时集气瓶内的气压),下列说法正确的是_____。
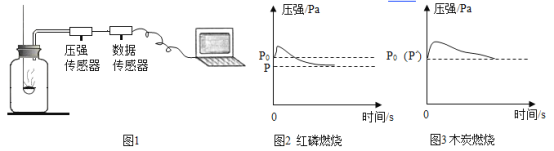
A 燃烧匙内所装红磷或木炭的多少对实验结果无影响
B 反应开始时集气瓶中压强瞬间变大是由燃烧放热造成
C P1=0.79P0,P2=P0是因为红磷比木炭消耗的氧气多
D 由图3可推出空气中氧气的含量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列是电解水反应示意图和装置。示意图①~③中,“●”表示氢原子,“O”表示氧原子。
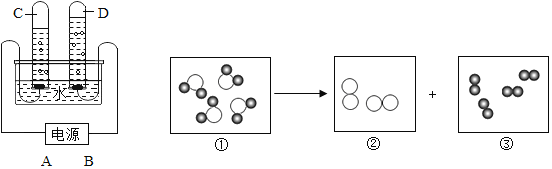
(1)图中表示化合物的是_____,表示单质的是_____(用序号填空)。
(2)②所代表的物质是左图中试管(填字母)_____中产生的气体,图中A是电源的_____(填“正”或“负”)极。
(3)为了探究C和D玻璃管分别产生的是什么气体,用燃着的木条分别在两个玻璃管口检验电解反应中产生的气体,观察并记录发生的现象,请填写下表:
C玻璃管 | D玻璃管 | |
现象 | _____ | _____ |
解释 | _____ | _____ |
(4)写出图中反应的化学符号表达式:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有如下转化关系:①Zn![]() ZnSO4,②ZnO
ZnSO4,②ZnO![]() ZnSO4,③Zn(OH)2
ZnSO4,③Zn(OH)2![]() ZnSO4。对这三种转化关系比较归纳正确的是( )
ZnSO4。对这三种转化关系比较归纳正确的是( )
A. 三种转化都只能通过与稀硫酸反应来实现B. 实验室制取硫酸锌的方法只有这三种
C. 上述四种物质中锌元素的化合价均为+2价D. 金属单质、金属氧化物、碱可以转化为盐
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲图是一氧化碳还原氧化铁的装置,乙图是炼铁高炉示意图。下列叙述中正确的是
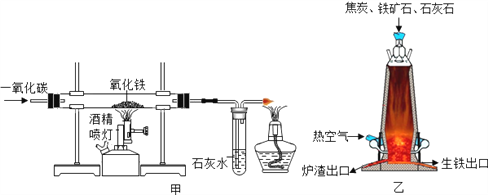
A. 炼铁的主要原理是:3CO+Fe2O3高温2Fe+3CO2
B. 乙图炼铁中原料焦炭的作用是只提供热量
C. 甲图中实验开始时应先点燃加热氧化铁的酒精喷灯
D. 两图中得到的铁是完全相同的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,广口瓶中盛有气体X,胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入广口瓶中,振荡,一段时间后可见小气球a膨胀鼓起。下表中的各组物质不会出现上述现象的是( )
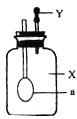
X | Y | |
A | CO | Ca(OH)2溶液 |
B | CO2 | NaOH溶液 |
C | HCl | Ca(OH)2溶液 |
D | SO2 | NaOH溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组在实验室里进行木炭还原氧化铜的实验。
(实验1)装置如图。
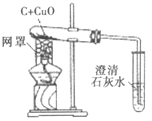
(1)木炭还原氧化铜的化学方程式为__,当碳与氧化铜的质量比为__(写最简整数比)时恰好完全反应。
(2)下列有关本实验的说法正确的是____(填字母)。
A 酒精灯加网罩以使火焰集中并提高温度
B 氧化铜发生了还原反应,木炭发生了氧化反应
C 观察到石灰水变浑浊即可证明氧化铜被还原了
D 反应后先撤出导气管,待试管冷却后再把其中的粉末倒出
(提出问题)实验1中,加热5分钟后仅能得到混有少量红色固体的黑色粉末。如何让木炭还原氧化铜时得到更多的铜呢?
(实验2)该小组同学在老师的指导下改进了实验,装置如图,加热2分钟后即得到紫红色有金属光泽的块状固体,且无黑色固体剩余。
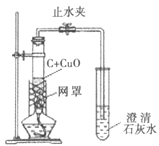
(1)刚烘干的木炭粉末与氧化铜粉末要在同一个研钵内充分研磨、混合均匀后再放入试管,这样做能使反应更充分,其主要原因是__。
(2)本实验所用的木炭与氧化铜的质量比为1︰10,碳需要略过量才能使氧化铜全部被还原,其主要原因是____。
(3)反应物放入试管后要尽量压实,并将试管竖直进行加热,使其下部完全被外焰包围,受热均匀,获得持续的高温。
(4)反应后关闭止水夹,让产物自然冷却,这时试管里残余的________就成了保护气。
(5)加了网罩的酒精灯火焰最高温度能达到800℃,而铜的熔点是1083℃。本实验获得了经熔化而成珠状或小块状的铜,可以推测木炭还原氧化铜的反应是________热量的。
(查阅资料)木炭还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4=CuSO4+Cu+H2O。
(拓展探究)将实验2得到的紫红色有金属光泽的块状固体全部研磨成粉末。
(1)将全部粉末放入烧杯中,加入足量稀硫酸,充分反应后,观察到______,证明实验2得到的铜中含有氧化亚铜;再经过滤、洗涤、干燥,得到纯净的单质铜1.52g。
(2)已知实验2使用的氧化铜粉末的质量为2.00g,不考虑实验过程中的损耗,则实验2得到的紫红色有金属光泽的块状固体中,单质铜的质量分数为______(计算结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习了二氧化锰过氧化氢分解有催化作用的知识后,某兴趣小组的同学提出问题:氧化铁能否起到类似于二氧化锰的催化作用呢?于是他们进行了以下探究.
(猜想)
Ⅰ.氧化铁不是反应的催化剂、也不参与反应,质量和化学性质反应前后均不变;
Ⅱ.氧化铁参与反应产生氧气,反应前后质量不变,但化学性质发生了改变;
Ⅲ.氧化铁是反应的催化剂,反应前后_____.
(实验)用天平称0.2g氧化铁,用试管取5mL 5%的过氧化氢溶液,进行如下实验:
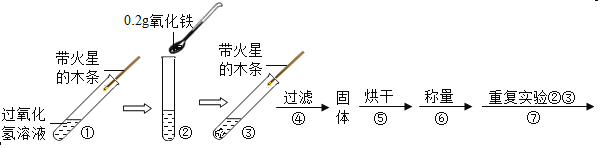
(注:氧化铁不溶于水,过滤可与水分离)
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
带火星的木条复燃. | _____ | 过氧化氢溶液中:_____ | 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立. |
(2)步骤①的目的是_____.
(3)写出上述有关过氧化氢分解的文字表达式_____.
(4)步骤⑦重复实验②、③的目的是_____.
(继续探究)从上述实验得出氧化铁是反应的催化剂.对同种催化剂,有哪些因素可能影响催化效果?请提出猜想并设计实验进行探究._____(注意:至少探究两种因素,答对一种因素奖励2分,本題最多奖励4分,化学试卷总分不超过60分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com