
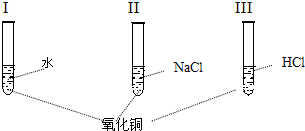
 氧化铜是一种黑色固体,可溶于稀盐酸.某同学想知道是稀盐酸中的哪种粒子使氧化铜溶解,设计了三个实验进行探究(如下图实验I、II、III).首先分别取少量氧化铜粉末于三支试管中,并编号为I、II、III,然后分别加入适量不同的液体.请你和他一起完成这三个实验,并通过探究证明是稀盐酸中的哪种粒子使氧化铜溶解.
氧化铜是一种黑色固体,可溶于稀盐酸.某同学想知道是稀盐酸中的哪种粒子使氧化铜溶解,设计了三个实验进行探究(如下图实验I、II、III).首先分别取少量氧化铜粉末于三支试管中,并编号为I、II、III,然后分别加入适量不同的液体.请你和他一起完成这三个实验,并通过探究证明是稀盐酸中的哪种粒子使氧化铜溶解.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:初中化学 来源: 题型:
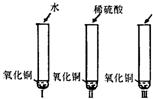 28、氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.
28、氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.查看答案和解析>>
科目:初中化学 来源: 题型:
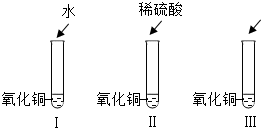
 21、氧化铜是一种黑色固体,可溶于稀硫酸:某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图I、II、III三个实验完成这次探究活动.
21、氧化铜是一种黑色固体,可溶于稀硫酸:某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图I、II、III三个实验完成这次探究活动.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤和方法 | 实验现象 | 实验结论 | |
| 方案1 | 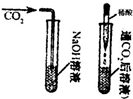 |
① 有气泡产生 有气泡产生 |
CO2和NaOH确实发生了化学反应 |
| 方案2 | ② 将CO2通入NaOH溶液后,再向溶液中滴加CaCl2溶液【或石灰水或BaCl2溶液或Ba(OH)2溶液】【也可仿照方案一的图示】 将CO2通入NaOH溶液后,再向溶液中滴加CaCl2溶液【或石灰水或BaCl2溶液或Ba(OH)2溶液】【也可仿照方案一的图示】 |
③ 出现白色浑浊(或产生白色沉淀) 出现白色浑浊(或产生白色沉淀) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com