解:(1)金属活动性顺序是:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au;
(2)金属和酸反应生成氢气,酸选用稀硫酸或稀盐酸都可;为比较两种金属的金属活动性强弱,除两种金属种类不同之外,其他都必须相同,故应选用药品A、D、F或B、D、F检验它们的金属活动性顺序;
(3)由放出氢气的质量与需要的时间关系图,可观察到等质量的两种金属与足量的酸反应时,金属甲首先完全反应,可判断金属甲的活动性比铁强;
(4)把一根洁净的金属甲丝浸入硫酸铝溶液中,过一会儿取出,在金属甲丝的表面没有明显的变化,说明金属甲活动性比铝弱,结合前面比铁强的判断,可推断金属甲为活动性比铝弱而比铁强的金属锌;
故答案为:
(1)Mg、Fe、Cu、Au;
(2)A、D、F或B、D、F;
(3)强;
(4)锌;
(5)解:生成金属铜的质量为x
Zn+CuSO
4═ZnSO
4+Cu
65 64
325g x
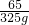
=
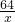
x═
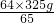
═320g
答:得到金属铜质量为320g.
分析:(1)利用对金属活动性的识记,判断活动性顺序表中所缺金属;
(2)利用金属和酸反应生成氢气的性质,通过控制反应条件,比较两种金属的金属活动性强弱;
(3)根据等质量的两种金属与足量的酸反应,放出氢气的质量与需要的时间关系图,判断金属甲与铁活动性强弱;
(4)根据金属与盐反应的条件分析,能反应说明该金属排在盐中金属的前面,不反应说明排在盐中金属的后面,利用实验现象判断金属活动性,推断金属的可能;
(5)根据锌与硫酸铜反应的化学方程式,可确定反应中锌与铜的质量比,利用这一质量关系,由金属锌的质量计算反应置换出金属铜的质量.
点评:主要考查了对金属活动性顺序的应用,掌握住金属和酸、盐反应的条件,培养学生对知识的灵活应用.

 金属活动性顺序在工农业生产和科学研究中有重要应用.请回答下列问题:
金属活动性顺序在工农业生产和科学研究中有重要应用.请回答下列问题: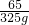 =
=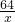
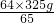 ═320g
═320g

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案




 金属活动性顺序在工农业生产和科学研究中有重要应用.请回答下列问题:
金属活动性顺序在工农业生产和科学研究中有重要应用.请回答下列问题: