
分析 根据在化合物中正负化合价代数和为零,进行解答.
解答 解:根据在化合物中正负化合价代数和为零,氢显+1价,氧显-2价,设R元素的化合价为x,则:
(+1)×2+x+(-2)×(2n+2)=0,则x=+(4n+2);
根据在化合物中正负化合价代数和为零,氯显-2价,设R元素的化合价为y,则:my+(-1)×n=0,则y=+$\frac{n}{m}$;氢氧根的化合价为-1,则R元素的氢氧化物的化学式为:$R(OH)_{\frac{n}{m}}$;
故答案为:+(4n+2);$R(OH)_{\frac{n}{m}}$.
点评 本题难度不大,掌握利用化合价的原则(化合物中正负化合价代数和为零)计算指定元素的化合价的方法即可正确解答本题.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:初中化学 来源: 题型:选择题
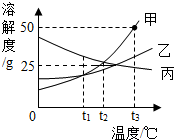 如图是甲、乙、丙三种固体物质的溶解度曲线,请你结合所给曲线,判断下列说法正确的是( )
如图是甲、乙、丙三种固体物质的溶解度曲线,请你结合所给曲线,判断下列说法正确的是( )| A. | 在t3℃时,甲的溶解度是50 | |
| B. | t2℃时,甲、丙二种物质的饱和溶液溶质质量分数为20% | |
| C. | t1℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数的大小关系是丙>甲>乙 | |
| D. | 温度降低到t2℃时,甲、乙的溶解度相等,得到甲的饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,所以可以做某些气体的干燥剂 | |
| B. | 患胃酸过多症的病人可口服含有NaHCO3或Al(OH)3的药物缓解胃酸过多 | |
| C. | 酸碱生成盐和水的反应,既是中和反应,又属复分解反应 | |
| D. | 稀释浓硫酸时一定要将水慢慢注入浓硫酸中 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ④⑤②③⑥①⑤ | B. | ④⑤②③①⑥⑤ | C. | ⑤②③⑥④①⑤ | D. | ④①⑤③⑥①⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 25℃时,氢氧化钠沉淀的pH范围 | |||
| Fe(OH)3 | Al(OH)3 | Mg(OH)2 | |
| 开始沉淀的pH | 1.5 | 3.3 | 10.4 |
| 沉淀完全的pH | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com