
锌粉、铁粉、镁粉的混合物3.8g与一定质量的溶质质量分数为25%的稀硫酸恰好完全反应,将反应后的混合物蒸发,得到11g固体(不含有结晶水),则反应中生成氢气的质量是
A.0.15g B.0.20g C.0.30g D.0.45 g
A
【解析】
试题分析:根据题意可知,锌粉、铁粉、镁粉的混合物和硫酸恰好完全反应,则有
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
Mg+H2SO4=MgSO4+H2↑
其中,三种金属的质量和为3.8g,三种盐的质量和为11g,所以,反应前后硫酸根的质量=11g-3.8g=7.2g,则纯硫酸的质量=7.2g÷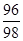 =7.35g,因此氢气的质量=硫酸中的氢元素的质量=7.35g-7.2g=0.15g,故选A。
=7.35g,因此氢气的质量=硫酸中的氢元素的质量=7.35g-7.2g=0.15g,故选A。
考点:质量守恒定律及其应用
点评:根据质量守恒定律可知,反应物的质量之和等于生成物的质量之和,反应前后元素的种类,原子的数目均不变。


科目:初中化学 来源:不详 题型:单选题
| A.用过滤的方法分离NaCl与NaNO3的混合物 |
| B.用盐酸除去混在铜粉中的少量镁粉和铝粉 |
| C.用锌与稀硝酸制取氢气 |
| D.用铁跟稀盐酸制取氯化铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com