
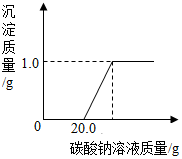
 有同学在做完“二氧化碳的制取和性质”实验后,发现废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,小科同学做了如下实验:取废液缸上层清液20.0克于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量与生成沉淀的质量的变化关系如图所示.求:
有同学在做完“二氧化碳的制取和性质”实验后,发现废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,小科同学做了如下实验:取废液缸上层清液20.0克于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量与生成沉淀的质量的变化关系如图所示.求:分析 (1)产生沉淀前消耗20.0g碳酸钠溶液,这是与废液中盐酸反应的碳酸钠溶液的质量,由于盐酸反应的碳酸钠溶液的质量和质量分数,根据二者反应的化学方程式可以计算出生成氯化钠和二氧化碳的质量.
(2)由沉淀质量碳酸钠溶液的质量分数,根据碳酸钠与氯化钙反应的化学方程式可以计算出与氯化钙反应的碳酸钠溶液的质量
和生成氯化钠的质量.两部分碳酸钠溶液合起来就是实际参加反应的碳酸钠溶液的质量.
(3)由两种反应生成的氯化钠的质量和除以所得溶液的质量就得到所得溶液中氯化钠的质量分数.
解答 解:(1)设与盐酸反应时,生成氯化钠的质量为x,生成二氧化碳的质量为y.
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 117 44
20.0g×5.3% x y
$\frac{106}{20.0g×5.3%}=\frac{117}{x}=\frac{44}{y}$
x=1.17g,y=0.44g
(2)设与氯化钙反应时,需要碳酸钠溶液的质量为z,生成氯化钠的质量为w.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
z•5.3% 1g w
$\frac{106}{z•5.3%}=\frac{100}{1g}=\frac{117}{w}$
z=20.0g,w=1.17g
实际参加反应的碳酸钠溶液的质量为
20.0g+20.0g=40.0g
(3)所得溶液中氯化钠的质量分数为$\frac{1.17g+1.17g}{20.0g+40.0g-1g-0.44g}$×100%≈4.0%
故答案为:(1)0.44g;(2)40.0g;(3)4.0%.
点评 本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,增加了学生分析问题的思维跨度,考查了学生整合知识的能力,难度较大.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:初中化学 来源: 题型:选择题
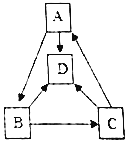 A、B、C、D四种物质之间的一步转化关系如图所示(部分反应物、生成物及反应条件未标出),它们均含有同种金属元素,A是石灰石的主要成分,B是氧化物,C为碱,D由两种元素组成.下列判断错误的是( )
A、B、C、D四种物质之间的一步转化关系如图所示(部分反应物、生成物及反应条件未标出),它们均含有同种金属元素,A是石灰石的主要成分,B是氧化物,C为碱,D由两种元素组成.下列判断错误的是( )| A. | B可用来配制波尔多液 | |
| B. | D物质可能属于氧化物 | |
| C. | 图中未涉及的基本反应类型是置换反应 | |
| D. | D在一定条件下也可以转化为A |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 常见的有机物:H2CO3、C2H6OH、CH2COOH | |
| B. | 常见的黑色固体:CuO、MnO2、Fe3O4 | |
| C. | 常见的氧化物:MgO、KMnO4、H2O | |
| D. | 常见的有还原性的物质:C、CO、O2 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 现象 | 结论 |
| 取2mL水于试管中,滴加紫色石蕊试液2~3滴 | 不变色 | 水分子不能使紫色石蕊变红色 |
| 取2mLNaCl溶液于试管中,滴加紫色石蕊试液2~3滴 | 不变色 | 氯离子不能使紫色石蕊变红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 ”代表氢原子,“
”代表氢原子,“ ”代表氮原子)两种物质在高温、高压和催化剂的条件下发生反应,回答以下问题:
”代表氮原子)两种物质在高温、高压和催化剂的条件下发生反应,回答以下问题: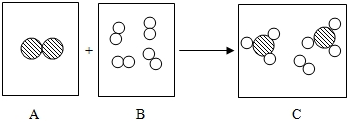
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁丝在空气中剧烈燃烧,发出耀眼白光,生成黑色固体 | |
| B. | 生锈的铁钉在稀盐酸里浸泡一段时间,铁锈消失,溶液为无色 | |
| C. | 将少量的过氧化氢溶液倒入洁净的试管内,立刻有大量气泡产生 | |
| D. | 向盐酸中滴入几滴紫色石蕊试液,试液变为红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com