
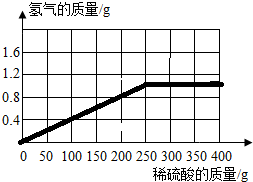
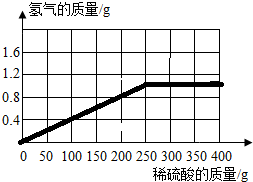
 (2012?乐陵市二模)为了测定某种黄铜(铜和锌的合金)的组成,取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:
(2012?乐陵市二模)为了测定某种黄铜(铜和锌的合金)的组成,取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加入稀硫酸质量(g) | 100 | 100 | 100 | 100 |
| 剩余固体质量(g) | 87 | 74 | 67.5 | 67.5 |

| 65 |
| 100g-87g |
| 98 |
| x |
| 19.6g |
| 100g |


科目:初中化学 来源: 题型:
 (2012?乐陵市二模)已知砷和铟的原子结构示意图如下:
(2012?乐陵市二模)已知砷和铟的原子结构示意图如下:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
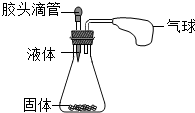 (2012?乐陵市二模)如图所示,挤压胶头滴管中的液体,使之与瓶中固体接触,可使小气球鼓起来.请写出符合下列要求的化学方程式:
(2012?乐陵市二模)如图所示,挤压胶头滴管中的液体,使之与瓶中固体接触,可使小气球鼓起来.请写出符合下列要求的化学方程式:
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com