
【题目】测定空气中氧气的体积分数可以采用下图甲乙两种装置。乙装置可视为甲的改进装置,在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化。
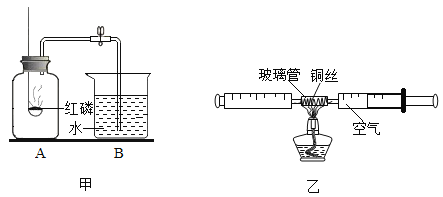
(1)在甲装置实验过程中,红磷燃烧产生大量白烟,当温度降到室温,打开止水夹,会观察到的现象是_____,写出红磷燃烧的符号表达式_____。
(2)在乙装置实验加热过程中,交替缓慢推动两个注射器活塞的目的是_____。
(3)写出乙装置实验中反应的符号表达式_____。
(4)乙装置实验中测得实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
25mL | 22mL |
由此数据可以推算出测定的空气中氧气的体积分数_____2l%(填“>”、“=”或“<”),造成该实验出现误差的原因可能是_____。(填序号)
①没有交替缓缓推动两个注射器活塞; ②读数时没有冷却至室温;
③加入铜丝量太多; ④加入铜丝量太少
(5)乙装置与甲装置相比较,优点在于_____(任答一点)。
【答案】水进入集气瓶,并且约占集气瓶容积的五分之一 P+O2![]() P2O5 使装置中的氧气完全反应 Cu+O2
P2O5 使装置中的氧气完全反应 Cu+O2![]() CuO < ①②④ 结果更准确
CuO < ①②④ 结果更准确
【解析】
(1)磷在氧气中燃烧生在五氧化二磷。反应后容器内的气压降低。当温度降到室温,打开止水夹,会观察到的现象是水进入集气瓶,并且约占集气瓶容积的五分之一;红磷燃烧的符号表达式为:P+O2![]() P2O5;
P2O5;
(2)在乙装置实验加热过程中,交替缓慢推动两个注射器活塞的目的是使装置中的氧气完全反应;
(3)铜在空气中加热与氧气反应生成氧化铜。乙装置实验中反应的化学方程式为:Cu+O2![]() CuO;
CuO;
(4)反应前注射器内气体的体积为25mL,反应后注射器内气体的体积为22mL,则氧气的体积为3mL,则空气中氧气的体积分数![]() 。,造成该实验出现误差的原因可能是:没有交替缓缓推动两个注射器活塞;读数时没有冷却至室温;加入铜丝量太少,故选①②④;
。,造成该实验出现误差的原因可能是:没有交替缓缓推动两个注射器活塞;读数时没有冷却至室温;加入铜丝量太少,故选①②④;
(5)乙装置与甲装置相比较,优点在于:结果更准确,操作更简单。


科目:初中化学 来源: 题型:
【题目】推理是一种重要的思维方法,以下推理合理的是( )
A. 酸中一定含有氢元素,所以含有氢元素的物质一定是酸
B. 置换反应有单质生成,所以有单质生成的反应一定是置换反应
C. 中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应
D. 化学反应伴随能量变化,所以金属腐蚀过程中一定伴随能量变化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有碳酸钠和氯化钠的固体混合物12.6g,其中含氧元素4.8g,将该混合物加入到一定质量的稀盐酸中,恰好完全反应,得到137g氯化钠溶液。计算:
(l)原固体混合物中碳酸钠的质量分数(结果保留至0.1%);
(2)所用稀盐酸中溶质的质量分数(结果保留至0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列各组物质的溶液,不用其他试剂,不能将它们一一鉴别出来的是( )
A.Ba(OH)2 NaCl Na2SO4 Na2CO3
B.NaOH Ca(OH)2 HNO3 Na2CO3
C.BaCl2 NaCl NaOH CuSO4
D.HCl CaCl2 AgNO3 Na2CO3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】Ⅰ.知物质甲乙丙及CuSO4的溶解度曲线如图所示:
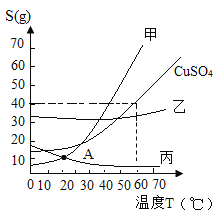
(1)对于处于 A 点的甲丙两物质的溶液,有关说法不正确的是(填编号)___________。
①都是饱和溶液; ②甲丙溶解度相等;
③溶液质量分数相等; ④溶液总质量相等;
⑤升温甲变为不饱和溶液,丙中析出固体
(2)若甲中混有少量的杂质乙,则除去乙的正确方法是(填编号)________。
①蒸发结晶 ②降温结晶 ③溶解过滤
(3)60℃时,CuSO4饱和溶液中溶质的质量百分数为(保留一位小数)__________。
(4)若将 16g 无水CuSO4加入足量CuSO4饱和溶液中,则析出CuSO45H2O 晶体的质量为(填编号)_____________。
①等于 16g ②大于 16 g 小于 25 g ③大于 25 g ④等于 25 g ⑤小于 25 g
Ⅱ.已知Cu2H2SO4 (浓) ![]() CuSO4SO22H2O 若将 36g Cu 和CuO 的混合物完全溶于过量热的浓 H2SO4中,冷却后加入水中稀释后再加入过量铁屑充分反应,放出气体质量为 1g,过滤洗涤干燥称重固体质量比加入的铁屑质量减少 24g,则原混合物中Cu 的质量为________________ g。
CuSO4SO22H2O 若将 36g Cu 和CuO 的混合物完全溶于过量热的浓 H2SO4中,冷却后加入水中稀释后再加入过量铁屑充分反应,放出气体质量为 1g,过滤洗涤干燥称重固体质量比加入的铁屑质量减少 24g,则原混合物中Cu 的质量为________________ g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学符号表示:
(1)两个氦原子_____;
(2)三个亚铁离子_____;
(3)氧化镁中镁元素显+2价_____;
(4)空气中含量最多的物质_____;
(5)保持氨气化学性质的最小粒子_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。小烧杯中有关量的变化情况见下图。其中肯定不正确的是( )
A. 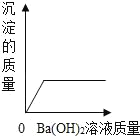 B.
B. 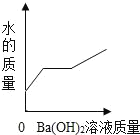
C. 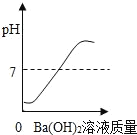 D.
D. 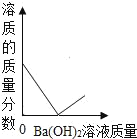
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
(物质制备)利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式:
FexOy+yH2![]() xFe+yH2O,Fe3C+2H2
xFe+yH2O,Fe3C+2H2![]() 3Fe+CH4
3Fe+CH4
(1)写出焙烧中氧化铁与CO反应的化学方程式____________.
(2)焙烧中加入焦炭的作用:______、_________。
(含量测定)为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验。已知 3CH4+4Fe2O3![]() 3CO2+6H2O+8Fe (假设每步反应都完全且不考虑装置内原来有空气对测定结果的影响).
3CO2+6H2O+8Fe (假设每步反应都完全且不考虑装置内原来有空气对测定结果的影响).
(3)主要实验步骤如下:

①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灯A、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量.
操作的先后顺序是①→ _____ →______ →______→_______ → _______ →⑦(填字母);
步骤②和③能否交换?_____(填“能”或“不能”)原因是______
(4)步骤⑤和⑥能否交换?_______(填“能”或“不能”)原因是_______
(5)装置F的作用是____________,若缺少装置F,则所测氧元素质量分数将______ (选填“偏大”、“偏小”或“不变”下同),碳元素的质量分数将 _______
(6)粗还原铁粉样品的质量为5.0g,装置B,E分别增重0.54g和0.44g.则样品中氧元素质量分数为____和碳元素的质量分数为________(要求计算过程).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】3018年5月13日,我国首艘001A型国产航母开始海试,标志着我国在航海及军事领域取得重大突破。根据所学知识填空。
(1)下图金属应用的实例,主要利用金属的导热性的是_____(填序号):
A  电缆 B
电缆 B  电热壶 C
电热壶 C  金属丝 D
金属丝 D  金属乐器
金属乐器
(2)建造航母用到了钛合金,构成金属钛的粒子是_____(填“原子”“分子”“离子”),工业制钛有一种及应为:![]() ,X的化学式为_____。
,X的化学式为_____。
(3)航母外壳用涂料覆盖,是为了防止钢铁材料与_____接触而锈蚀。
(4)为了探究航母材料中锌、铁、钢三种金属活动性强弱,某同学设计了下列实验(每步均充分反应),其中能达到目的是_____(填序号)。
A 稀盐酸中加入足量铁粉后,再加铜粉,最后加入锌粉
B ![]() 溶液中加入足量铁粉后,再加入
溶液中加入足量铁粉后,再加入![]() 溶液
溶液
C ![]() 溶液中加入足量铜粉后,再加入铁粉
溶液中加入足量铜粉后,再加入铁粉
(5)冶炼2900t含四氯化三铁80%的磁铁矿石.理论上能得到含杂质2%的生铁的质量是_____t(结果精确到0.l).
(6)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是_____(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com