
| 实验 物质用量 | 第一次 | 第二次 | 第三次 |
| 所取合金的质量/g | 10 | 10 | 10 |
| 所用稀硫酸的质量/g | 50 | 100 | 150 |
| 剩余固体质量/g | 3.5 | 3.0 | 3.0 |
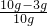 ×100%═70%;
×100%═70%; =
= ,
, ×100%=19.6%.
×100%=19.6%. ×100%”计算即可;
×100%”计算即可; ×100%”计算即可.
×100%”计算即可.

科目:初中化学 来源: 题型:
| 实验 物质用量 |
第一次 | 第二次 | 第三次 |
| 所取合金的质量/g | 10 | 10 | 10 |
| 所用稀硫酸的质量/g | 50 | 100 | 150 |
| 剩余固体质量/g | 3.5 | 3.0 | 3.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验编号 | 所需合格样品的质量/g | 所取稀盐酸的质量/g | 生成氢气的质量/g |
| 1 | 10.0 | 40.0 | 0.1 |
| 2 | 10.0 | 50.0 | 0.1 |
| 3 | 20.0 | 36.5 | 0.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问:
某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问:查看答案和解析>>
科目:初中化学 来源: 题型:
 为了测定某铜锌合金中锌的质量分数,进行了如下实验:准确称取20.0g合金,向其中不断加入稀硫酸,观察到有气泡逸出,实验过程中测得产生气体的质量与所加稀硫酸的体积关系如图所示.回答下列问题:
为了测定某铜锌合金中锌的质量分数,进行了如下实验:准确称取20.0g合金,向其中不断加入稀硫酸,观察到有气泡逸出,实验过程中测得产生气体的质量与所加稀硫酸的体积关系如图所示.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
| 第一次 | 第二次 | 第三次 | |
| 所取合金的质量/g | 25 | 25 | 50 |
| 所用稀硫酸的质量/g | 120 | 160 | 100 |
| 生成氢气的质量/g | 0.4 | 0.4 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com