
| 氢氧化钠 体积:500mL 化学式:NaOH 相对分子质量:40 密度:1.5 g/cm3 质量分数:50%(1)用20mL氢氧化钠溶液可以配制质量分数为10%的氢氧化钠溶液 (2)利用刚配制好的氢氧化钠除去混有RCl2的NaCl固体(R代表某二价金属).取20g该固体样品,全部溶解在100g水中,再加入刚配制好的溶液80g,混合到恰好完全反应后过滤,得到固体的质量为9.8g. ①题中发生反应的化学方程式为 ②利用已知条件求解反应生成NaCl质量(x)的比例式为 ③R的元素符号是 ④原混合物中NaCl的质量分数为 ⑤向反应后所得溶液中加入173.8g水,则此时溶液中溶质的质量分数是 分析:(1)用标签中的说明数据,根据稀释前后溶质质量不变,计算稀释后溶液质量; (2)①运用题目假设的化学式写出反应的化学方程式; ②根据化学方程式,利用8g氢氧化钠的质量,列出计算生成氯化钠质量的比例式; ③根据参加反应的氢氧化钠和生成的滤渣的质量,利用化学方程式可计算出R的相对原子质量,从而可确定R. ④根据化学方程式可计算出RCl2的质量,据此计算混合物中氯化钠的质量,利用氯化钠质量除以样品质量求出样品纯度; ⑤计算加水稀释反应后溶液溶质质量分数. 解答:解:(1)用20ml氢氧化钠溶液可以配制质量分数为10%的氢氧化钠溶液=20ml×1.5g/cm3×50%÷10%=150g. (2))①根据题中告诉的信息可写出反应的化学方程式为:2NaOH+RCl2=R(OH)2↓+2NaCl. ②80g10%的氢氧化钠的质量=80g×10%=8g;设生成氯化钠的质量为x,R的相对原子质量为y 2NaOH+RCl2=R(OH)2↓+2NaCl 80 34+y 117 8g 9.8g x
x=11.7g
y=64 铜的相对原子质量为64,故R的元素符号为Cu. 设参加反应的RCl2的质量为z 2NaOH+RCl2=R(OH)2↓+2NaCl 80 135 8g z
z=13.5g 那么原混合物中NaCl的质量分数为:
反应后溶液中溶质的质量分数为:
故答案为: (1)150g; (2)①2NaOH+RCl2=R(OH)2↓+2NaCl ②
③Cu ④32.5% ⑤5% 点评:写出化学方程式,利用氢氧化钠的质量求出生成氯化钠的质量,这是进一步解决问题的关键.  
练习册系列答案
 孟建平错题本系列答案 孟建平错题本系列答案 超能学典应用题题卡系列答案 超能学典应用题题卡系列答案
相关习题
科目:初中化学 来源: 题型: 23、实验室有一瓶氢氧化钠溶液,甲同学提出“该项溶液是否吸收了空气中的二氧化碳呢?”于是对该溶液的组成部分进行了探究.乙同学首先对该溶液的溶质作了以下①~③种假设,请教老师后又补充了④和⑤的假设 ①是NaOH②是Na2CO3③是NaOH和Na2CO3④是NaHCO3⑤是Na2CO3和NaHCO3 [查阅资料]硝酸钙、氯化钠、硝酸钠的溶液均呈中性 [实验]丙同学通过一系列实验证明第③种假设是正确的.请回答下列问题; (1)若溶液中含有NaOH和Na2CO3你将如何检验?你所有的试剂是 A和E .(可供选择的试剂有:A硝酸钙 B氢氧化钙 C氯化钠 D硝酸钠E酚酞) (2)有关的实验步骤和现象是 取少量溶液于试管中,先向试管中加入过量的硝酸钙溶液,然后再加入酚酞试液.先有白色沉淀生成,加入无色酚酞试液后,溶液呈红色 .(3)有关化学反应方程式是 Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 .查看答案和解析>> 科目:初中化学 来源: 题型: (1)为了解决煤炭开发造成的“三废”和不安全事故,我国已开始“煤炭地下气化”的科技攻关.其原理是使煤在地下与高温水蒸气反应产生一氧化碳和氢气.写出这个反应的化学方程式 (2)解放军特种兵进行夜间射击训练时,在密闭的囊形靶体内充入一定体积分数的氧气和氢气,当高温高速的子弹击中靶体时,靶体内物质发生反应,此时会听到 (3)实验室有一瓶氢氧化钠固体由于放置时间较长,使用前需检验其是否变质. ①取少量样品加入试管中,滴入 ②写出氢氧化钠在空气中变质的化学方程式 (4)如图是探究质量守恒的实验装置,锥形瓶内插有一根上端系有一小气球、下端能与白磷接触的玻璃管.引燃白磷,气球胀大,待锥形瓶冷却至室温后,气球部分缩进玻璃管内,气球缩进的原因是 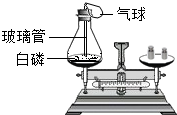 (5)二氧化碳是常用的灭火剂,但有的金属着火却不能用二氧化碳灭火.如金属镁在高温下可以在二氧化碳中继续燃烧,生成黑色和白色两种固体粉末.请写出反应的化学方程式 查看答案和解析>> 科目:初中化学 来源: 题型:解答题 实验室有一瓶氢氧化钠溶液,甲同学提出“该项溶液是否吸收了空气中的二氧化碳呢?”于是对该溶液的组成部分进行了探究.乙同学首先对该溶液的溶质作了以下①~③种假设,请教老师后又补充了④和⑤的假设 |