
| 元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 氯 | 氩 |
| 元素符号 | Na | Mg | Al | Si | P | Cl | Ar |
| 原子结构示意图 |  |  |  |  |  |  |  |

分析 (1)根据元素符号的写法以及原子结构的最外层电子数来分析;
(2)根据铝原子的最外层电子数来分析;
(3)根据磷原子结构以及相对原子质量来分析;
(4)根据粒子结构示意图写出粒子的符号;根据最外层电子数与元素的化学性质的关系分析;
(5)原子的相对原子质量反映了其实际质量的大小,原子质量越大时其相对原子质量越大,所以当物质质量都相等的前提下,相对原子质量越大,所含的原子数越少;相对原子质量越小,所含的原子数越多.
解答 解:(1)Na的元素符号为P,其原子结构中最外层有1个电子,易失去1个电子;故填:Na;失去;
(2)铝原子最外层电子数为3,小于4个,易失去3个电子使次外层成为最外层,达到8电子稳定结构,铝带金字旁,属于金属元素,铝离子的符号表示为Al3+.故填:Al3+;
(3)磷原子核外有15个电子,因为在原子中,质子数=核外电子数,所以核内有15个质子,磷的相对原子质量为31,故中子数=31-15=16;故填:15;16;
(4)由元素Sr形成的粒子结构示意图可知,核内质子数比核外的电子数多2个,该微粒是锶离子,符号为:Sr2+.
最外层电子数决定元素的化学性质,最外层电子数相同的元素,化学性质相似,由于元素Sr的原子的外层电子数是2,C原子的最外层也有2个电子,具有相似的化学性质.A只有一个电子层,该层上有2个电子,属于稳定结构;B最外层有6个电子,易得到2个电子;D最外层有8个电子,都属于稳定结构.
故答案为:Sr2+;C;
(5)题干中各原子相对原子质量由小到大排列为:镁原子<铁原子<铜原子<锌原子,因为当四种金属质量相同时,含原子数最多的是相对原子质量最小的元素,所以所含原子个数最多的是镁原子.
故选:D.
点评 本题考查了对元素周期表中的一个小格所提供的信息的了解情况,及原子结构示意图所表示出的信息和意义,还考查了相对原子质量的概念及其应用.掌握相对原子质量与其真实质量成正比的关系是解题的关键.


 科学实验活动册系列答案
科学实验活动册系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
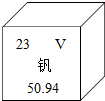 钒被誉为“合金的维生素”,钒元素的部分信息如图,下列有关钒的说法正确的是( )
钒被誉为“合金的维生素”,钒元素的部分信息如图,下列有关钒的说法正确的是( )| A. | 属于非金属元素 | B. | 该元素质子数为23 | ||
| C. | 原子核外电子数为28 | D. | 相对原子质量为50.94g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 15 g | B. | 18g | C. | 20g | D. | 30 g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

 ,该图表示(填序号)C.
,该图表示(填序号)C.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com