钾是农作物生长所必需的一种营养元素.现有一种钾肥样品,其成分为碳酸钾和硫酸钾.某同学为测定该钾肥中碳酸钾的质量分数,在10g钾肥样品中逐滴加入溶质质量分数为20%的硫酸溶液至恰好完全反应,测得消耗硫酸溶液的质量为24.5g,该过程中发生反应的化学方程式为 ________.
请计算:
(1)24.5g20%的硫酸溶液中,溶质的质量为 ________g.
(2)钾肥样品中碳酸钾的质量分数为 ________.
(3)硫酸钾中钾元素的质量分数为 ________(精确到0.1%); ________g硫酸钾中含有39g钾元素.
解:(1)24.5g20%的硫酸溶液中溶质的质量为24.5g×20%=4.9g
(2)设钾肥样品中碳酸钾的质量分数为x.
K
2CO
3+H
2SO
4═K
2SO
4+CO
2↑+H
2O
138 98
10g?x 4.9g
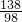
=
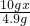
,
x=69%
(3)硫酸钾中钾元素的质量为
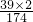
×100%≈44.8%
硫酸钾的质量为39g÷(
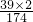
×100%)=87g
故答案为:
(1)4.9g
(2)69%
(3)44.8%;87g
分析:(1)由硫酸溶液的质量和质量分数,根据溶质质量分数的计算公式,可以计算出硫酸溶液中溶质的质量.
(2)由硫酸的质量根据碳酸钾与硫酸反应的化学方程式可以计算出碳酸钾的质量,在由样品的质量和质量分数的计算公式可以计算出样品中碳酸钾的质量分数.
(3)根据硫酸钾的化学式和化合物中元素的质量分数计算方法,可以计算出硫酸钾中钾元素的质量分数;由钾元素的质量和硫酸钾中钾元素的质量分数,根据化合物中元素的质量分数的计算方法,可以计算出硫酸钾的质量.
点评:本题主要考查有关化学式的计算、有关化学方程式的计算、有关溶质质量分数的计算,难度较大.

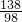 =
=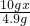 ,
,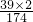 ×100%≈44.8%
×100%≈44.8%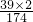 ×100%)=87g
×100%)=87g

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案