解:[查阅资料]
<资料4>根据信息“分离出NaHCO
3,使其充分受热即可分解制得纯碱及两种常见的氧化物”知,反应物为碳酸氢钠,条件是加热,生成物除碳酸钠外,还有两种常见的氧化物,根据碳酸氢钠的组成判断应是水和二氧化碳,
故方程式为2NaHCO
3
Na
2CO
3+H
2O+CO
2↑.
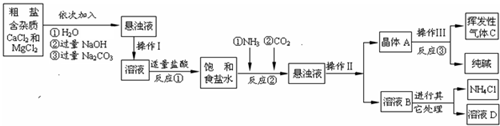
【问题讨论】(1)粗盐中含有少量可溶性杂质(MgCl
2和CaCl
2),氯化镁能与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,
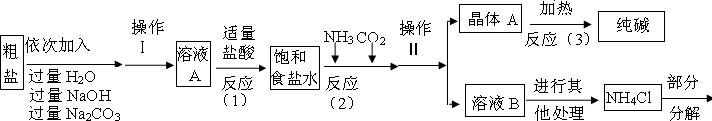
氯化钙能与碳酸钠反应生成碳酸钙沉淀和氯化钠,所以A中的溶质主要是氯化钠,由于氢氧化钠和碳酸钠过量,溶液A中也有氢氧化钠和碳酸钠;过滤是把固体与液体分开的操作,操作Ⅱ将混合物分成了晶体与溶液,正是通过过滤操作.
(2)实验目的是除去实验中钙镁离子,加入氢氧化钠是为了将镁离子变为氢氧化镁沉淀除去,加入碳酸钠是将钙离子变为碳酸钙沉淀除去.
(3)根据生产流程中涉及的方程式和流程图,发现二氧化碳、氨气、氯化氢、碳酸钠为重复使用的物质.
(4)涉及的两个反应是氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠:MgCl
2+2NaOH=Mg(OH)
2↓+2NaCl
碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠:Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl
组成确定:加入硝酸银溶液生成白色沉淀,不溶于稀硝酸,是氯化银沉淀,说明原碳酸钠中含有氯化钠.
【含量测定】甲组:解:设样品中碳酸钠的质量为X.
Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑ 质量差
106 117 11
X 13.1g-12.0g=1.1g
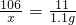
解之得:X=10.6g
样品中碳酸钠的质量分数为
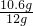
×100%=88.3%
乙组:乙组测定的质量分数偏小,其直接原因是C装置增重少,可能原因是生成的二氧化碳气体没有被C中的烧碱完全吸收.
丙组:因为同质量的碳酸钠生成碳酸钡的质量远大于碳酸钙,称量误差小于碳酸钙,计算出碳酸钠的质量分数误差也就越小.
故答案为:
[查阅资料]<资料4>2NaHCO
3
Na
2CO
3+H
2O+CO
2↑;
【问题讨论】
(1)①NaCl、NaOH、Na
2CO
3;②过滤;
(2)除去镁离子;除去钙离子
(3)ABCE;
(4)MgCl
2+2NaOH=Mg(OH)
2↓+2NaCl;Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl
组成确定:NaCl
【含量测定】甲组:88.3%;
乙组:生成的二氧化碳气体没有被C中的烧碱完全吸收.
丙组:同质量的碳酸钠生成碳酸钡的质量远大于碳酸钙,称量误差小.
分析:[查阅资料]<资料4>根据信息“分离出NaHCO
3,使其充分受热即可分解制得纯碱及两种常见的氧化物”书写.
【问题讨论】(1)根据粗盐的成分及它们和氢氧化钠、碳酸钠等的化学性质回答前一空;根据过滤的原理和适用范围回答后一空.
(2)根据实验目的是除去食盐中杂质进行分析.
(3)根据生产流程中涉及的方程式和流程图分析回答.
(4)根据复分解反应原理进行书写方程式.
组成确定:加入硝酸银溶液生成白色沉淀,不溶于稀硝酸,是氯化银沉淀.
【含量测定】甲组:所得固体与纯碱样品的质量差实际上是生成的氯化钠与碳酸钠的质量差,据此可根据化学方程式,利用差量法算出样品中碳酸钠的质量,再计算其质量分数.
乙组:根据乙组测定的质量分数偏小,其直接原因是C装置增重少,可从二氧化碳的吸收是否完全来回答.
丙组:可根据生成的产物的质量大小对计算误差的方面进行考虑.
点评:本题考查涉及知识点多,考查学生利用课本知识解决新问题能力,能加深学生对课本知识的理解,训练学生的思维能力.


 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为______(必须要有写出计算过程,请在下方写出)
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为______(必须要有写出计算过程,请在下方写出) Na2CO3+H2O+CO2↑.
Na2CO3+H2O+CO2↑.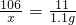
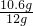 ×100%=88.3%
×100%=88.3% Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;

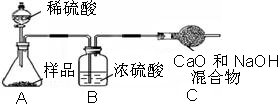 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为