
| A. | 9:8 | B. | 9:4 | C. | 17:12 | D. | 9:16 |
分析 铜不能稀硫酸反应,氧化亚铜和稀硫酸反应生成硫酸铜、铜和水,可以假设氧化亚铜的质量,根据化学方程式可以计算反应生成铜的质量,生成的铜的质量和原混合物中铜的质量之和是4.8g.
解答 解:设原混合物中的Cu2O的质量为x,生成铜的质量为y,
Cu2O+H2SO4=CuSO4+Cu+H2O,
144 64
x y
$\frac{144}{64}$=$\frac{x}{y}$
y=$\frac{64x}{144}$,
根据题意有:6.8g-x+$\frac{64x}{144}$=4.8g,
x=3.6g,
原混合物中的Cu的质量为:6.8g-3.6g=3.2g,
则原混合物中的Cu2O和Cu质量比为:3.6g:3.2g=9:8,
故选:A.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:初中化学 来源: 题型:解答题
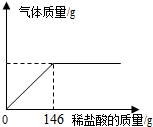 某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品24.0g,向其中加入10%的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,(1)小明要从反应后的溶液中提取NaCl应采用的方法是蒸发结晶;
某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品24.0g,向其中加入10%的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,(1)小明要从反应后的溶液中提取NaCl应采用的方法是蒸发结晶;查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
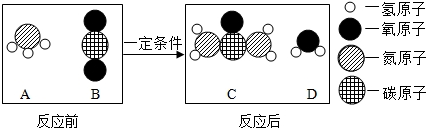
| A. | 图中A、B、C、D四种物质都是氧化物 | |
| B. | 该反应属于复分解反应 | |
| C. | 该反应前后分子种类、原子种类均没有改变 | |
| D. | 反应中A、B物质的质量比为17:22 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 冰水共存物、石灰水、空气都是混合物 | |
| B. | 小苏打、纯碱、高锰酸钾都是盐 | |
| C. | 硝酸钾、磷酸铵、硝酸铵都是复合肥 | |
| D. | 塑料、合成橡胶、铜锌合金都是合成材料 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com