
【题目】某学习小组对用碳酸盐可以制取CO2进行如下研究:
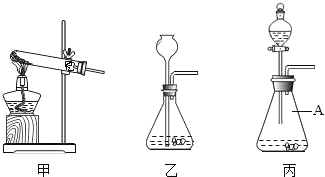
(1)向盛有等质量块状纯碱固体和块状碳酸钙固体的两装置中同时分别加入足量的相同质量相同浓度的稀盐酸,测得生成的CO2质量与时间关系如下表.
生成CO2质量/g | 2 | 4 | 6 | 8 | 12 | |
时间/s | 块状碳酸钙固体 | 10 | 25 | 40 | 60 | 85 |
块状纯碱晶体 | 4 | 9 | 15 | 25 | 40 | |
①从表中数据获得信息_____.
②如图是一组实验装置,该实验除用到电子秤外,还需用图中_____装置(填所选装置编号).
③实验中小红同学用沾有紫色石蕊试液的玻璃棒放在所选装 置的导管口检验生成的气体,观察到的现象为_____,由此她认为产生的气体为CO2.小军同学认为小红同学的验证不严密,理由是_____.
④请写出块状碳酸钙固体与稀盐酸反应方程式为_____.
⑤由上表数据可知,若用块状纯碱晶体代替块状石灰石制取CO2,为保证实验时间接近,所用稀盐酸质量分数需_____(选填“变大”、“变小”或“不变”).
(2)若需制取较纯净的CO2,则最好选择下列哪组药品?_____,因为:_____.
A 块状石灰石与稀盐酸 B 块状石灰石与稀硫酸
C 块状纯碱晶体与稀盐酸 D 块状纯碱晶体与稀硫酸
(3)丙图中标号仪器A的名称为_____,用装置甲制取氧气的化学反应方程式为_____.
【答案】纯碱晶体与盐酸反应的速度快 丙 试液变红 也可能是盐酸挥发出的氯化氢气体使石蕊试液变红 CaCO3+2HCl═CaCl2+H2O+CO2↑ 变小 D 有盐酸参加的反应产物不纯,碳酸钙与硫酸反应又不能进行到底 锥形瓶 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
【解析】
(1)①表中数据分析纯碱晶体与盐酸反应的速度快,故答案:纯碱晶体与盐酸反应的速度快。
②因为分液漏斗可以控制稀盐酸的滴加速度,而长颈漏斗不能,所以装置丙便于控制反应的发生,反应速率,故答案:丙。
③酸能使石蕊变红色和二氧化碳和水反应生成碳酸,故答案:试液变红;小军同学认为小红同学的验证不严密,这是因为盐酸具有挥发性,也能使石蕊溶液变红,因此小军的理由是:也可能是盐酸挥发出的氯化氢气体使石蕊试液变红。
④碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,故答案:CaCO3+2HCl═CaCl2+H2O+CO2↑
⑤从表中数据可以看出,随着溶液浓度越小反应速度越慢,但和同样浓度的盐酸溶液反应碳酸钠晶体比碳酸钙反应快,若用块状纯碱晶体代替块状石灰石制取CO2,为保证实验时间接近,所用稀盐酸质量分数需:变小。
(2)盐酸是氯化氢气体的水溶液,盐酸具有挥发性,用稀盐酸制取的CO2气体中容易混有少量的氯化氢气体,但稀硫酸不会;块状的石灰石和稀硫酸反应不能进行到底,所以制取较纯净的CO2,则最好选择:D(块状纯碱晶体与稀硫酸反应),其原因是:有盐酸参加的反应产物不纯,碳酸钙与硫酸反应又不能进行到底.
(3)丙图中标号仪器A的名称为:锥形瓶;因为装置甲反应条件是加热,且试管口略向下倾斜,试管口还有一团棉花,所以该装置是加热高锰酸钾制取氧气,反应的化学方程式是: ![]()


 名师点拨卷系列答案
名师点拨卷系列答案科目:初中化学 来源: 题型:
【题目】初中化学几种常见物质的相互转化关系如图所示其中甲、乙为单质,A、B、C、D为化合物,且A与B的组成元素相同,C与D的组成元素也相同,且能相互转化。其余反应条件、部分反应物已略去。试推断:
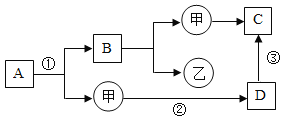
⑴写出有关物质的化学式:
D_____、乙_____
⑵写出下列化学反应的方程式:
①_____;③_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向盛有50g10%Ba(OH)2溶液的烧杯中慢慢滴加稀硫酸至过量,如图(纵坐标表示烧杯中其他量的变化)所有有关量的变化与所加入稀硫酸质量的关系错误的是( )
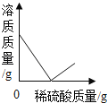
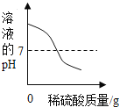
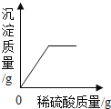
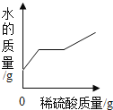
A. B. C. D.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】取2克含有杂质氯化钠的硫酸钠固体溶于98克水中,固体全部溶解,向溶液中滴加氯化钡溶液到沉淀不再生成为止,共滴加氯化钡溶液50克,将反应后的物质过滤得到147.67克的滤液。计算:
(1)求原混合物中硫酸钠的质量分数;
(2)求滤液中溶质的质量分数(计算结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为探究催化剂对双氧水(H2O2)分解的催化效果,某研究小组做了如下实验:
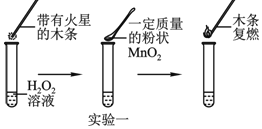
实验一:图中的实验能否证明MnO2是双氧水分解反应的催化剂?并说明理由______。
数据记录表
1%H2O2溶液(mL) | 50 | 50 | 50 |
加入MnO2的质量(g) | 0.1 | 0.2 | 0.4 |
测量40秒末得到O2体积(mL) |
实验二:从上面表格的设计可以看出,该实验的目的是______。
实验三:学习了催化剂知识后,某化学探究小组开始了“寻找新的催化剂”研究性实验:
(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
(实验探究)
实验步骤 | 实验现象 |
I.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag. | |
IV分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 |
(实验结论)
(1)A中产生的气体是______;
(2)实验II.III证明:氧化铁的______和______在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的文字表达式______。
(实验评价)
(4)实验设计IV的目的是______;
(5)若实验IV观察到D试管中产生气泡的速率更快,由此你可以得到的结论是:______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是( )
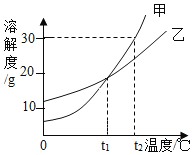
A. 甲的溶解度大于乙的溶解度
B. t1℃时,甲、乙两种物质的溶液中,溶质的质量分数相等
C. t2℃时,甲的饱和溶液溶质质量分数为30%
D. t1℃时,甲、乙的饱和溶液分别恒温蒸发20g水,析出晶体的质量相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】5克铁、锌、镁三种金属的混合物与100g某浓度的稀硫酸刚好完全反应,生成0.2g氢气,则反应后所得溶液中溶质的总质量是( )
A. 0.2gB. 10.2gC. 14.6gD. 104.8g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是实验室制取和收集气体的常用装置图,请根据所给的装置图回答下列问题:
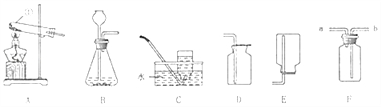
(1)请写出装置图A中标号①的仪器名称:_____;
(2)实验室既能制取氧气,也能制取二氧化碳的发生装置为_____(填字母代号),请写出用该装置制取二氧化碳的化学方程式_____。
(3)实验室常用氯化铵固体和熟石灰固体混合加热制取极易溶于水的氨气(NH3的相对分子质量为17),请根据以上装置图选择,在实验室制取氨气时的发生装置和收集装置为_____ (填字母代号);
(4)实验室里通常用MnO2与浓盐酸在加热条件下制取氯气,同时生成MnCl2和水,请写出该反应的化学方程式_____,如果用F装置收集氯气(Cl2的相对分子质量为71),气体应从_____ (填“a”或“b”) 端管口通入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】Na2SO3在印染、造纸等行业中有着广泛的应用。某研究小组采用图1所示流程制备Na2SO3。
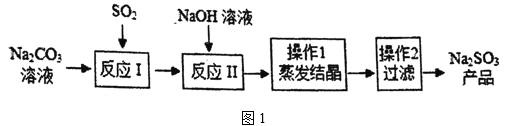
[查阅资料]反应Ⅰ中随着SO2的增加,依次发生如下化学反应:
①SO2+H2O+2Na2CO3=Na2SO3+2NaHCO3;
②SO2+2NaHCO3=Na2SO3+2CO2↑+H2O;
③SO2+H2O+Na2SO3=2NaHSO3。
(1)H2SO3的名称为亚硫酸,则Na2SO3的名称为_____。
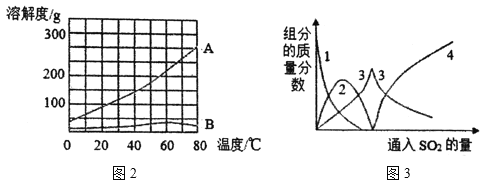
(2)操作1采用蒸发结晶的方法分离混合溶液得到Na2SO3晶体。由此可知,Na2SO3的溶液曲线与下图2中_____(填“A”或“B”)物质的溶解度曲线相似。
(3)操作2中使用玻璃棒的作用是_____。
(4)反应Ⅰ通入SO2后,溶液中有关组分的质量分数变化如上图3所示。图中曲线3表示Na2SO3的质量分数变化情况,则曲线1表示_____(填化学式,下同)的质量分数的变化情况,曲线2表示_____的质量分数的变化情况。
(5)反应Ⅱ加入NaOH溶液的目的是将反应Ⅰ生成的NaHSO3转化为Na2SO3,该化学反应方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com