
| A. | 公路上的积雪用氯化钠消除 | |
| B. | 把海产品放入甲醛溶液中保鲜 | |
| C. | 胃酸过多,服用胃舒平(主要称为为氢氧化铝) | |
| D. | 碱面涩口,加食醋改良口感 |
分析 A、根据盐的性质进行分析,盐溶于水后能减低水的凝固点,据此进行分析判断;
B、根据甲醛是有毒的物质分析;
C、根据酸碱中和的原理来分析;
D、根据碱面的主要成分是碳酸钠,能与食醋反应分析.
解答 解:A、在积雪上撒盐,盐溶于水时形成的盐溶液的凝固点比水的凝固点低,从而使冰雪在较低的温度下也能融化,故A正确;
B、甲醛是有毒的物质,浸泡海产品,会对人体造成危害,故B错误;
C、胃酸中的成分是盐酸能与氢氧化铝发生中和反应而治疗胃酸过多,故C正确;
D、碱面的主要成分是碳酸钠,能与食醋反应,改良口感,故D正确.
故选B.
点评 本题难度不大,了解氯化钠的用途、甲醛的毒性、酸与碱的反应等即可正确解答本题.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 饱和溶液就是不能再 溶解其他物质的溶液 | |
| B. | 饱和溶液一定浓溶液 | |
| C. | 一定温度下,向氯化钠的饱和溶液加水,可变成不饱和溶液 | |
| D. | 稀溶液一定是不饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
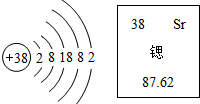
| A. | 锶的相对原子质量是87.62g | |
| B. | 锶原子的中子数为38 | |
| C. | 锶离子的核外电子数是36,形成的锶离子符号是Sr2+ | |
| D. | 从这两张图中能得出锶原子的质子数为为87 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
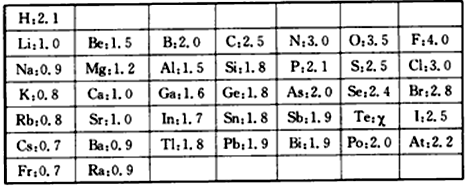
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
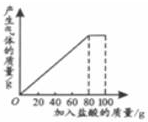 有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象.
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象. | 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com