
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:初中化学 来源: 题型:
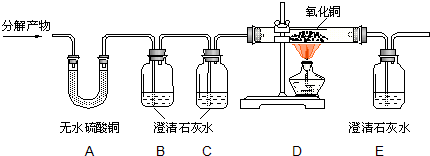
| 装置(含其中药品) | 反应前的质量 | 反应后的质量 |
| 装置B | m1 | m2 |
| 装置D(玻璃管及其中氧化铜) | n1 | n2 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g加入5mL 6%的H2O2溶液中 | 剧烈反应,放出大量热量,产生大量气体 | 生成物中的MnO2催化分解H2O2 |
| 2 | 取0.2gMnO2加入5mL a a (H2O2质量分数)的H2O2溶液中 |
平稳反应,发出热量,持续产生气体 | MnO2催化分解H2O2 |
| 3 | 取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | b b |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的 30% NaOH溶液 30% NaOH溶液 ,充分反应后过滤,滤渣备用. |
粉末部分溶解,并有气体放出. | 合金中一定含有 铝 铝 . |
| ②取步骤①所得滤渣,加过量的 10% 盐酸 10% 盐酸 ,充分反应. |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 铜和铁 铜和铁 . |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2011年北京市东城区中考化学一模试卷(解析版) 题型:解答题
| 实验序号 | 实验操作 | 实验现象 |
| Ⅰ |  | 水垢变白、变疏松, 澄清石灰水变浑浊 |
| Ⅱ |  | 固体部分溶解, 放出热量, 滤液的pH约为12 |
| Ⅲ | 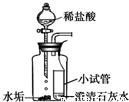 | 实验现象是______. |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com