
分析 (1)根据氢氧化钠和硫酸镁反应的方程式利用氢氧化钠的质量可求反应的硫酸镁和生成沉淀的质量,而后利用质量守恒定律可知硫酸镁溶液的量,进而可得硫酸镁的质量分数;
(2)依据反应前后物质是否能电离以及离子的个数关系分析解答即可.
解答 解:(1)设参加反应的MgSO4的质量为x,生成Mg(OH)2沉淀的质量为y
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
80 120 58
m×20% x y
$\frac{80}{120}$=$\frac{m×20%}{x}$;
$\frac{80}{58}$=$\frac{m×20%}{y}$;
x=0.3 m,y=0.145 m
由m+MgSO4溶液的质量=3m+0.145m
知 MgSO4溶液的质量=2.145m
所以 MgSO4溶液中MgSO4的质量分数=$\frac{0.3m}{2.145m}$×100%=14.0%;
(2)由反应方程式2NaOH+MgSO4=Na2SO4+Mg(OH)2↓可知溶液中的钠离子不会变化(来源于氢氧化钠溶液),而随着硫酸镁的滴加硫酸根离子则会不断变大,但由于Na2SO4可知溶液中的钠离子和硫酸根离子的个数比应该为2:1,溶液中的氢氧根离子随着硫酸镁的滴加会不断变少最终完全反应时消失;故可得如下图象[注:图中应反映出恰好完成反应后,N(Na+):N(SO42-)=2:1]
故答案为:(1)所加硫酸镁溶液中溶质的质量分数为14.0%;
(2) .
.
点评 此题是一道化学方程式计算题,熟练掌握相关方程式的计算和利用质量守恒定律是解题的关键.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:初中化学 来源: 题型:填空题
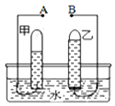 3月22日是“世界水日”,水与人类的生活和生产密切相关,请回答下列问题:
3月22日是“世界水日”,水与人类的生活和生产密切相关,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Mg和MgO | B. | MgO和Mg(OH)2 | C. | MgO和MgCO3 | D. | Mg和MgCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题


查看答案和解析>>
科目:初中化学 来源: 题型:填空题
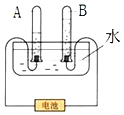 如图是电解水实验的示意图:
如图是电解水实验的示意图:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 偏大 | B. | 偏小 | C. | 不变 | D. | 无法判断 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青蒿素的相对分子质量为282克 | |
| B. | 青蒿素中氧元素的质量分数为11.9% | |
| C. | 青蒿素中C、H、O三种元素的质量比为90:11:40 | |
| D. | 青蒿素由15个碳原子、22个氢原子和5个氧原子构成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com