
【题目】(6分)家中蒸馒头用的纯碱中含有氯化钠,某实验小组要测定该纯碱中碳酸钠的质量分数。取6 g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡,此时烧杯中没有不溶物,其消耗稀盐酸61.7 g,测得反应后溶液的质量为65.5 g。请帮助实验小组完成以下计算:
(1)样品中碳酸钠的质量分数是多少?(计算结果保留至0.1%)
(2)反应后溶液中溶质的质量分数是多少?
【答案】(1)88.3% (2)10%
【解析】
试题分析:碳酸钠与稀盐酸反应生成的是氯化钠、水和二氧化碳,依据质量守恒定律化学反应前后物质的总质量不变,故减少的质量即为生成的二氧化碳的质量。利用化学方程式根据反应的质量比即可计算出样品中碳酸钠的质量和生成的氯化钠的质量。
解:反应中生成CO2的质量为:6 g+61.7 g-65.5 g=2.2 g
设原混合物中 Na2CO3的质量为x ,生成的NaCl的质量为y。
Na2CO3+ 2HCl ==2NaCl+ H2O + CO2↑
106 117 44
x y 2.2 g
![]() =
= ![]() x=5.3 g
x=5.3 g
![]() =
= ![]() y=5.85 g
y=5.85 g
原混合物样品中碳酸钠的质量分数=5.3 g÷6 g×100%=88.3%
NaCl的质量=5.85 g+6 g-5.3 g=6.55 g
氯化钠的质量分数=6.55 g÷65.5 g×100% =10%
答:原混合物样品中碳酸钠的质量分数为88.3%。氯化钠的质量分数为10%。


科目:初中化学 来源: 题型:
【题目】(4分)甲、乙两种固体物质的溶解度曲线如下图一所示。
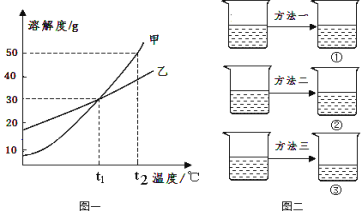
(1)t1℃时,甲物质的溶解度是 ;乙物质的溶解度随温度的升高而 (“增大”或“减小”)
(2)将45g甲物质分成三等分,分别加入到盛有100mL水的烧杯中,形成t1℃时甲的不饱和溶液。如上图二所示,再分别通过蒸发溶剂、增加溶质和降低温度三种方法中的一种,将它们都变成甲的饱和溶液。此时,烧杯②中溶质质量最大,烧杯③中的溶液质量最小。则方法一是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E是初中化学中常见的五种物质,它们都含有一种相同的元素,右图表示各物质之间的转化关系。其中,A为食盐的主要成分, B中含钡元素,D为有颜色溶液,E为蓝色溶液,其它物质的溶液都为无色;反应⑤和⑥为置换反应,其它均为复分解反应。
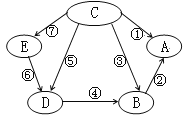
(1)写出物质C的化学式 。
(2)反应②的现象为 。
(3)反应⑥的化学方程式为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)下图为A、B、C三种物质的溶解度曲线,据图回答:

(1)20℃时,A、B、C三种物质的溶解度由大到小顺序是 。
(2)将t2℃时三种物质等质量的饱和溶液分别降温到t1℃时,析出溶质最多的是 。
(3)从A的饱和溶液中析出晶体的最好方法是 。
(4)20℃时,将30 g A物质放入50 g水中,充分搅拌,所得溶液的质量是 g。
(5)若将t2℃三种物质的饱和溶液分别降温到t1℃时,则三种溶液中溶质的质量分数由大到小的顺序是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)某金属冶炼厂的管道烟泥中含有某些单质,其中Cu约占10.3%、Zn约占5.0%、
S约占1.2%。现欲回收铜和锌,并对硫进行环保处理,主要步骤如下图所示:
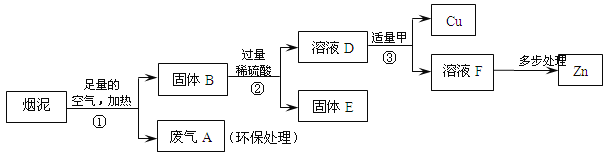
已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物;
![]() ;
;![]()
(1)步骤①产生的废气A中,一定含有的有害气体是_____。
(2)步骤③中反应的化学方程式是______________。
(3)下列说法正确的是__________。
a.②、③中的操作均包含过滤
b.溶液D和溶液F中ZnSO4的质量相等
c.溶液D中ZnSO4的质量大于CuSO4的质量
d.若步骤①中空气不足量,不会导致锌的回收率降低
查看答案和解析>>
科目:初中化学 来源: 题型:
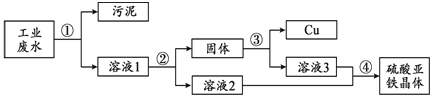
【题目】(3分)工业废水中含有硫酸亚铁、硫酸铜和污泥。某同学设计了利用废水制备硫酸亚铁晶体(FeSO4·7H2O)并回收铜的实验方案,流程如下:
已知:硫酸亚铁晶体受热易分解。
回答下列问题:
(1)步骤②中需加入的物质及目的是 。
(2)步骤③中发生反应的化学方程式为 。
(3)步骤④的操作是蒸发浓缩、降温结晶、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com