
【题目】实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8g 10%的NaOH溶液。然后往烧杯中滴加该盐酸。反应过程中溶液的pH与滴入盐酸的质量关系如图所示。请回答下列问题:
(1)配制了8g 10%的NaOH溶液,需要水的质量为多少g;
(2)计算该盐酸的溶质质量分数;(写出计算过程)
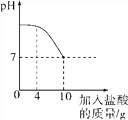
(3)当滴入4g盐酸时,烧杯内溶液中钠元素的质量为多少g。
【答案】(1)7.2g
(2)解:设10g稀盐酸中氯化氢的质量为x。
NaOH+HCl===NaCl+H2O
40 36.5
8g×10% x
![]() =
=![]() x=0.73g
x=0.73g
该盐酸的溶质质量分数为x=![]() ×100%=7.3%。
×100%=7.3%。
答:该盐酸的溶质质量分数为7.3%。
(3)0.46g
【解析】(1)配制了8g 10%的NaOH溶液,需要水的质量为8g -8g× 10%=7.2g。
(2)解:设10g稀盐酸中氯化氢的质量为x。
NaOH+HCl = NaCl+H2O
40 36.5
8g×10% x
![]() =
=![]() ,x=0.73g
,x=0.73g
该盐酸的溶质质量分数为x=![]() ×100%=7.3%。
×100%=7.3%。
(3)当滴入4g盐酸时,烧杯内溶液中钠元素的质量为∶8g ×10%×![]() ×%=0.46g。
×%=0.46g。
答∶(1)配制了8g 10%的NaOH溶液,需要水的质量为7.2g。(2)该盐酸的溶质质量分数是7.3%。
(3)当滴入4g盐酸时,烧杯内溶液中钠元素的质量为0.46g。
点睛∶这是一道结合图像的综合计算题,溶液由溶质和溶剂组成,正确书写化学方程式是正确解决这道题的关键所在。灵活应用质量守恒定律是解决本题的有效方法。


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:
【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定反应后溶液的pH,得到了如图所示的pH曲线,请回答:

(1)由图可知该实验操作是将______________滴加到另一种溶液中。
(2)该反应的化学方程式为__________________________________________。
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了做标记,他设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3===CaCO3↓+2NaCl。
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现____________________________的现象。结论:该样品是a处溶液。
②为进一步确定b和c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液 | ________________________ | 该样品为b处溶液 |
先有____________产生,后有________________产生 | 该样品为c处溶液,并推知溶液中的阳离子有________________ |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】赣南的客家围屋如同城堡,可以抵御外敌入侵。现有五种物质盐酸、硫酸、氢氧化钠、氯化钡和碳酸钠作为围屋的守护“卫士”,只有相邻物质间能发生反应才能组成守护的防线(如图所示)。其中物质A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分。(提示:碳酸钡不溶于水)
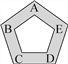
(1)A物质是________;
(2)B与C反应的化学方程式为__________________________________;A与E反应时的实验现象为________________________________;
(3)现有下列物质作为“外敌”分别对围屋发起进攻,若该物质与两位相邻的守护“卫士”都能发生反应才能攻破防线,那么能攻入围屋的物质是________。(填序号)
①铁 ②氧化铁 ③二氧化碳 ④氢氧化钡
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关水的知识中,正确的说法是( )
A.水是一种最常见的溶剂,自然界中的水大多是纯净物
B.冰是由氧元素和氢元素组成的
C.用滤纸过滤可以除去水中的所有杂质
D.电解水时生成的氢气和氧气的质量比为2:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究。
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【做出猜想】a.可能与金属本身的性质有关;b.可能与盐酸的浓度有关。
【设计探究】实验所用金属均已用砂纸打磨。
【实验Ⅰ】为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。写出锌与盐酸发生反应的化学方程式:________________________________。从实验现象可判断金属活动性:Zn________(选填“<”“=”或“>”)Fe。

【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是________________________。
【实验Ⅱ】为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是______________________________________。
所用药品、实验数据如表:
实 验 编 号 | 选用 金属 (均取 2g) | 盐酸质 量分数 (均取 50mL) | ||||||
产生氢气的体积/mL | ||||||||
第 1 min | 第 2 min | 第 3 min | 第 4 min | 第 5 min | 前5分钟 共收集气体 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【得出结论】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是________________________________________________________________________。
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸反应最后变慢的原因:________________________________________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某物质经分析含有氢、氧两种元素,则下列对该物质的说法中正确的是( )
A. 一定是纯净物 B. 一定是化合物 C. 一定是混合物 D. 一定不是单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com