
碳酸钠和氯化钙溶液反应不仅可以用Na2CO3+CaCl2=CaCO3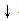 +2NaCl表示,还可以用 CO32﹣+Ca2+=CaCO3
+2NaCl表示,还可以用 CO32﹣+Ca2+=CaCO3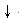 表示,后者叫离子方程式.书写离子方程式时按以下步骤进行:①“写”:写出化学方程式.(Na2CO3+CaCl2=CaCO3
表示,后者叫离子方程式.书写离子方程式时按以下步骤进行:①“写”:写出化学方程式.(Na2CO3+CaCl2=CaCO3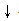 +2NaCl)
+2NaCl)
②“拆”:将易溶易解离的酸、碱和盐拆写成离子形式;沉淀、气体和水仍用化学式表示,不能拆写成离子形式.(2Na+ +CO3 2﹣+Ca 2+ +2Cl﹣=CaCO 3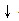 +2Na + +2Cl﹣)
+2Na + +2Cl﹣)
③“删”:删去方程式左右两边相同的离子.(CO32﹣+Ca2+ =CaCO3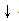 )
)
④“查”:检查方程式左右两边各元素的原子个数和电荷总数是否相等.
注意:离子方程式中生成物为沉淀或气体时需标出“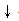 ”或“↑”.
”或“↑”.
根据以上信息,结合已学知识,回答下列问题:
(1)HCl在水中解离出 (填离子符号);NaOH在水中解离出 (填离子符号).
(2)CaCO3+2HCl=CaCl 2+CO2↑+H2O的离子方程式是 .
科目:初中化学 来源: 题型:阅读理解
 21、化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究:
21、化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液放在试管中,再滴入氯化钙溶液 | 若生成白色沉淀 | 碳酸钠过量 |
| 若无明显现象 | 恰好反应 |
| 实验步骤 | 实验现象和结论 |

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
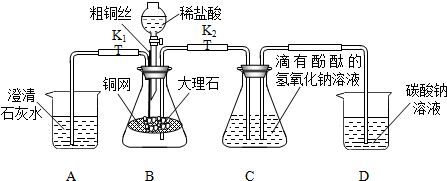
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
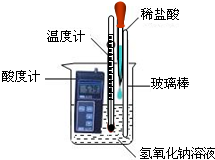 化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究:
化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究:| 实验方法 | 可能看到的现象 | 结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com