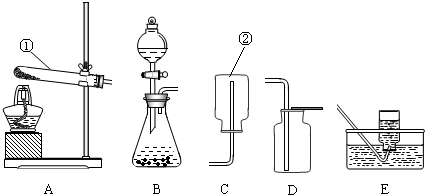
解:(1)①是试管;②是长颈漏斗;
(2)高锰酸钾加热分解产生锰酸钾、二氧化锰和氧气,故发生装置的特点是固体加热型的B装置;反应的方程式为:2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(3)大理石和稀盐酸反应生成氯化钙、水和二氧化碳,反应的方程式为:CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;发生装置的特点是固液常温型的C装置,用浓硫酸干燥,二氧化碳的密度比空气大,故用向上排空气法收集,故选择CDE组装一套制取干燥二氧化碳的装置;
(4)解:①设氯化钙的质量为X
CaCl
2+Na
2CO
3=CaCO
3↓+2NaCl
111 100
X 5g
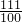
=
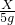
解得X=5.55克
②CaCl
2+Na
2CO
3=CaCO
3↓+2NaCl
Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑
根据质量守恒定律,30g碳酸钠溶液中的钠元素质量和最终反应后的溶液中的氯化钠的钠元素质量是相等的,先求30g碳酸钠溶液中的钠元素的质量为30×26.5%×

×100%=3.45g,
则b点时氯化钠的质量为3.45g/(

×100%)=8.775g
此时溶液的质量为:50g+30g-5g-1.1g=73.9g
氯化钠的质量分数为
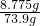
×100%=11.9%
答:50g废液中含氯化钙5.55g,b点表示的溶液中氯化钠的质量分数为11.9%.
故答案为:(1)试管;长颈漏斗;
(2)B; 2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(3)CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;CDE;
(4)解:①设氯化钙的质量为X
CaCl
2+Na
2CO
3=CaCO
3↓+2NaCl
111 100
X 5g
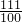
=
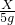
解得X=5.55克
②CaCl
2+Na
2CO
3=CaCO
3↓+2NaCl
Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑
根据质量守恒定律,30g碳酸钠溶液中的钠元素质量和最终反应后的溶液中的氯化钠的钠元素质量是相等的,先求30g碳酸钠溶液中的钠元素的质量为30×26.5%×

×100%=3.45g,
则b点时氯化钠的质量为3.45g/(

×100%)=8.775g
此时溶液的质量为:50g+30g-5g-1.1g=73.9g
氯化钠的质量分数为
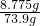
×100%=11.9%
答:50g废液中含氯化钙5.55g,b点表示的溶液中氯化钠的质量分数为11.9%.
分析:(1)熟练掌握化学常见仪器的名称和用途;
(2)根据反应物的状态和反应条件选择发生装置;高锰酸钾加热分解产生锰酸钾、二氧化锰和氧气;
(3)大理石和稀盐酸反应生成氯化钙、水和二氧化碳;发生装置的特点是固液常温型,用浓硫酸干燥,用向上排空气法收集干燥的二氧化碳;
(4)由图象可知废液中有盐酸剩余,加入头10克碳酸钠与盐酸反应生成了1.1克二氧化碳,盐酸反应没了,氯化钙与碳酸钠反应生成了5克沉淀,据此就可以算出氯化钙和生成的氯化钠的质量了.
点评:本题考查了常见气体的制取和收集及根据化学方程式的计算,在计算中关键是根据坐标分析已知量进行相关解题.


 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;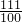 =
=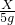
 ×100%=3.45g,
×100%=3.45g, ×100%)=8.775g
×100%)=8.775g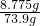 ×100%=11.9%
×100%=11.9% K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;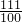 =
=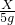
 ×100%=3.45g,
×100%=3.45g, ×100%)=8.775g
×100%)=8.775g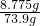 ×100%=11.9%
×100%=11.9%

 阅读快车系列答案
阅读快车系列答案