(2013?镇江)某实验小组利用废硫酸液制备K
2SO
4并研究CaSO
4?2H
2O加热分解的产物.
(一)K
2SO
4的制备
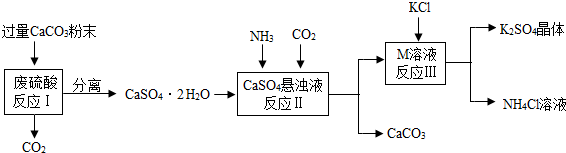
(1)将CaCO
3研成粉末的目的是
加快反应速率
加快反应速率
.
(2)上述流程中可循环使用的物质有CO
2和
CaCO3
CaCO3
(填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是
常温下K2SO4的溶解度小
常温下K2SO4的溶解度小
.
| 物质 |
KCl |
K2SO4 |
NH4Cl |
M |
| 溶解度/g(25℃) |
34.0 |
11.1 |
37.2 |
19.5 |
(4)不用水而用饱和K
2SO
4溶液洗涤反应Ⅲ所得晶体的目的是
减少K2SO4的溶解
减少K2SO4的溶解
;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入
c
c
(选填序号,下同),振荡、静置,再向上层清液中滴加
a
a
,观察现象即可判断.
a.AgNO
3溶液 b.过量的BaCl
2溶液 c.过量的Ba(NO
3)
2溶液
(二)研究CaSO
4?2H
2O加热分解的产物.
(5)分离所得的CaSO
4?2H
2O含有CaCO
3,可用盐酸除去,该的化学反应方程式
CaCO3+2HCl=CaCl2+CO2↑+H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
.
(6)为了测定CaSO
4?2H
2O和CaCO
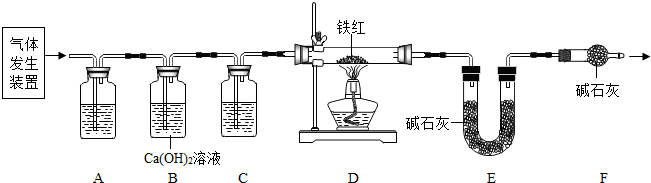
3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验.
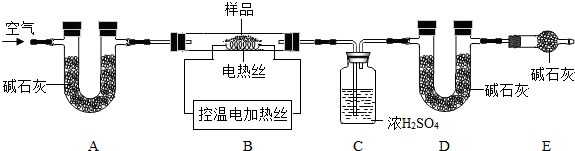
①实验前首先要
检查装置的气密性
检查装置的气密性
,再装入样品.装置A的作用是
除去空气中的CO2和H2O
除去空气中的CO2和H2O
.
②已知CaSO
4?2H
2O在160℃生成CaSO
4,1350℃时CaSO
4开始分解;CaCO
3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m
1g b.反应后玻璃管中固体的质量为m
2g
c.装置C实验后增重m
3g d.装置D实验后增重m
4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将
偏小
偏小
(填“偏大”、“偏小”或“无影响”).你认为还可选用上述的
bc
bc
(选填序号)两个数据组合也可求出x:y的值.
(7)CaSO
4?2H
2O受热会逐步失去结晶水.取纯净CaSO
4?2H
2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示.①G点固体的化学式是
CaSO4?H2O
CaSO4?H2O
.
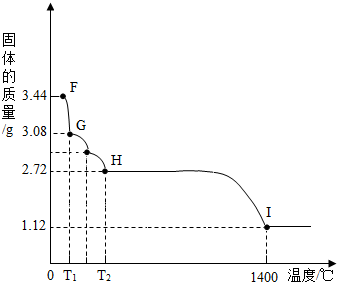
②将T
2~1400℃温度段加热固体所产生的气体通入酸性KMnO
4溶液中,溶液褪色,则H~I段发生反应的化学方程式为
.