
化学中常常出现“1+1≠2”的有趣现象,但也有例外,下列符合“1+1=2”的事实是( )
A.20℃,1 L水与1 L酒精混合后的体积等于2 L
B.20℃,1 g过氧化氢溶液和1 g二氧化锰混合充分反应后,剩余物质的总质量为2 g
C.20℃,1 g镁在1 g氧气中燃烧会得到2 g氧化镁
D.20℃,1 g硫粉在1 g氧气中完全燃烧后生成2 g二氧化硫
 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:
化学基础知识是学好化学的关键,请按下列要求填空。
(1)请用化学符号填空:
①氦元素 ; ②两个氢分子 ;
 ③铜原子 ; ④铵根离子 。
③铜原子 ; ④铵根离子 。
(2)图1是某微粒的结构示意图,其中 X= ,该微粒在化学反应中易(填“得”或“失”)电子;写出一条从图2中获得的信息 。(合理均可)。
(3)下图是汽车尾气治理过程中某反应的微观示意图,请按要求回答问题。
 |
①图中体现了在化学变化前后一定不变的是 (填序号)。
A.元素种类 B.原子种类 C.分子数目 D.原子数目
②图中发生反应的化学方程式为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
央视播出的《舌尖上的中国Ⅱ》主要介绍了“饮食健康”,下列做法符合“饮食健康”的是( )
| A.用鱼粉、明胶合成鱼翅 | B.在白酒中加入超量塑化剂使其口感更好 |
| C.在排骨汤中放入食盐调味 | D.在鸡饲料中添加各种激素使鸡速成 |
查看答案和解析>>
科目:初中化学 来源: 题型:
下列实验操作、现象与结论对应关系正确的是 ( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向醋酸中加入氢氧化钠溶液 | 无明显现象 | 二者之间不发生反应 |
| B | 向溶质质量分数为5%的过氧化氢溶液中加入少量氧化铜 | 有大量气泡产生 | 氧化铜起催化作用 |
| C | 将两根铁丝分别伸入硫酸铜溶液和硝酸银溶液中 | 两根铁丝上 | 金属的活动性顺序为Fe<Cu<Ag |
| D | 用导管分别对准浸没在热水中和冷水中的白磷通气 | 热水中的白磷燃烧,冷水中的白磷不燃烧 | 燃烧的条件之一是温度达到着火点 |
查看答案和解析>>
科目:初中化学 来源: 题型:
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
| 3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1) 第三周期共有非金属元素 种。
(2) 第11号元素与第17号元素组成的化合物的化学式是 ,构成该物质的微粒是
(选填“分子”、“原子”或“离子”)。
(3) 在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是 (选填选项字母);
a.C和Ne b.Be和Mg c.Al和Si  d.F和Cl
d.F和Cl
(4) 第9号氟元素和氢元素形成的化合物的水溶液氢氟酸(HF)可用于玻璃雕刻,其主要原理是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅气体(SiF4)和水,该反应的化学方程式为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
属于分解反应的是
A.HCl + NaOH NaCl + H2O B.2Mg + CO2
NaCl + H2O B.2Mg + CO2 2MgO + C
2MgO + C
C.MgCl2 Mg + Cl2↑ D.2Na + Cl2
Mg + Cl2↑ D.2Na + Cl2 2NaCl
2NaCl
查看答案和解析>>
科目:初中化学 来源:2014-2015学年江苏省无锡市崇安区九年级中考一模化学试卷卷(解析版) 题型:探究题
(10分)黄铁矿(主要成分为FeS2,杂质不含硫元素)是我国大多数硫酸厂制取硫酸
的主要原料。化学课外活动小组为测定某黄铁矿中FeS2含量进行了如下的实验探究(假设
每步反应均完全)。
【查阅资料】①4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
②Na2SO3+H2O2=Na2SO4+H2O
【实验探究】
Ⅰ.称取1.60 g黄铁矿样品放入下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

【问题讨论】
(1)Ⅰ中装置中甲瓶内盛放的试剂是氢氧化钠溶液,其作用是 。
【含量测定】
(2)Ⅱ中最终得到的4.66g固体是 (填物质的名称或化学式)。
(3)计算该黄铁矿中FeS2的质量分数。(请写出计算过程)
【交流反思】
(4)如果缺少甲装置,则最终测得FeS2的质量分数将会 (填“偏大”“偏小”或“不变”)。
(5)Ⅱ中证明所加BaCl2溶液过量的方法是 。
【拓展应用】
工业上以黄铁矿为原料生产硫酸的工艺流程图如下所示:
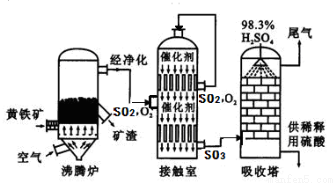
(6)接触室中发生反应的化学方程式为 。化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用到较稀的硫酸。要把100g上述浓硫酸稀释成质量分数为10%的硫酸,需要水的质量是 g。硫酸是一种重要的化工产品,用途十分广泛,请写出稀硫酸的一种用途 。
(7)依据生产硫酸的工艺流程图,下列说法正确的是 (填字母)。
A.为使黄铁矿充分燃烧,需将其粉碎
B.催化剂能够提高SO2的反应速率和产量
C.SO2可做为生产硫酸的原料循环再利用
D.沸腾炉排出的矿渣可供炼铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com