
分析 根据黄铜的成分铜和锌的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气;根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应锌的质量,进而计算出铜的质量和铜的质量分数
解答 解:根据质量守恒定律,产生氢气的质量为:20g+100g-119.8g=0.2g.
设黄铜样品中锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.2g
$\frac{65}{x}=\frac{2}{0.2g}$
x=6.5g
黄铜样品中铜的质量分数为:$\frac{20g-6.5g}{20g}$×100%=67.5%.
答案:黄铜样品中铜的质量分数为67.5%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 水是人及一切生物生存所必需的,为了人类和社会经济的可持续发展,我们应该了解一些有关水的知识.请你回答:
水是人及一切生物生存所必需的,为了人类和社会经济的可持续发展,我们应该了解一些有关水的知识.请你回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 偏向放铁片一边 | B. | 偏向锌片一边 | C. | 无法判断 | D. | 天平平衡 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 向燃着的酒精里添加酒精 | |
| B. | 加热后的试管立即用水冲洗 | |
| C. | 实验室药液溅进眼睛中立即用纸巾擦拭 | |
| D. | 实验台上的酒精失火立即用湿抹布扑盖 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  稀释等质量的30%H2SO4和10% H2SO4 | |
| B. | 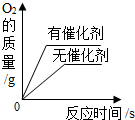 用等质量、等浓度的双氧水分别制取氧气 | |
| C. |  将等质量的Mg和Fe投入到足量稀H2SO4中 | |
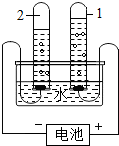
| D. |  电解水 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图所示是甲、乙、丙三个实验的示意图,根据图中所发生的化学反应现象及化学反应原理,进行总结归纳并回答下列问题:
如图所示是甲、乙、丙三个实验的示意图,根据图中所发生的化学反应现象及化学反应原理,进行总结归纳并回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 汞--水银 | B. | 氧化钙--熟石灰、消石灰 | ||
| C. | 氢氧化钙水溶液--石灰水 | D. | 氢氧化钠--烧碱、火碱、苛性钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com