人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属.请回答:
(1)每年世界上钢铁的产量很高,钢铁的锈蚀也给人类带来了巨大的损失.铁在空气中锈蚀,实际上是铁跟空气中的______、______共同作用的结果;
(2)在CuCl2和MgCl2 的混合溶液中,加入过量的铁粉,充分反应后过滤,所得固体为______.
(3)应用金属活动性顺序能帮助我们进一步学习金属性质.已知下列各组物质间均能发生置换反应.
A.Fe 和CuSO4 溶液 B.Mg和MnSO4 溶液 C.Mn和FeSO4 溶液
①写出Fe 和CuSO4 溶液反应的化学方程式______.
②Mn、Fe、Mg、Cu四种金属的活动性由强到弱的顺序______.
(4)黄铜是铜、锌合金,外观呈现金黄色,和金相似.它用于制造机器、电器零件等.
①请选用一种化学方法区别黄铜和金______.
②为测定某黄铜样品中铜的质量分数,取一定质量该黄铜样品加入到100g稀盐酸中,恰好完全反应,产生氢气0.1g.试求该黄铜样品中锌的质量和稀盐酸中溶质的质量分数.
【答案】
分析:(1)依据铁的生锈条件解决问题.
(2)根据镁铜铁的活动性判断,铁能置换铜但不能置换出镁.
(3)①金属与盐反应会生成金属与新盐;②可利用提供的三个反应对金属的活动性进行判断.
(4)①利用锌能与盐酸反应而金不能与酸反应进行区分;②利用氢气的质量结合化学方程式的计算对锌的质量以及氯化氢的质量进行计算即可.
解答:解:(1)钢铁生锈的基本条件是水与氧气.
(2)由于金属活动性镁>铁>铜,所以CuCl
2和MgCl
2 的混合溶液中,加入过量的铁粉,能置换出铜,加上剩余的铁粉,所以剩余固体是:铜与铁;
(3)①Fe 和CuSO
4 溶液反应产物是硫酸亚铁与铜.
②金属与盐溶液的反应规律是活动性较强的金属能还原出活动性较弱的金属,所以由A.Fe 和CuSO
4 溶液能反应可得活动性Fe>Cu;B.Mg和MnSO
4 溶液反应可得Mg>Mn;C.Mn和FeSO
4 溶液能反应可得Mn>Fe,三种金属的活动性顺序是:Mg Mn Fe Cu;
(4)①金和稀盐酸不反应,黄铜中的锌和稀盐酸反应生成氢气,有气泡出现.
②设黄铜中锌的质量为x,稀盐酸中溶质的质量为y.
Zn+2HCl=ZnCl
2+H
2↑
65 73 2
x y 0.1g
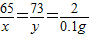
x=3.25g,y=3.65g
盐酸质量分数为
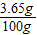
×100%=3.65%
答:锌的质量是3.25g,所用的稀盐酸质量分数为3.65%.
故答案为:(1)O
2 H
2O (2)Fe、Cu (3)①Fe+CuSO
4═Fe SO
4+Cu ②Mg Mn Fe Cu (4)①加入稀盐酸,冒气泡的为黄铜.或加热变黑的为黄铜(合理即可);②3.25g,3.65%
点评:该题难度适中,主要考查了对金属活动性顺序的灵活运用,及根据化学方程式进行有关的计算,培养学生应用知识的能力.

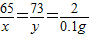
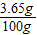 ×100%=3.65%
×100%=3.65%



 人们的日常生活离不开金属,高科技新材料的开发和利用也需要金属.
人们的日常生活离不开金属,高科技新材料的开发和利用也需要金属.
