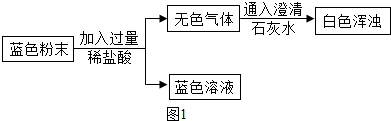
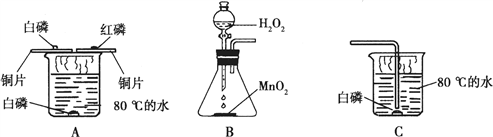
某研究性学习小组对白磷和红磷燃烧的条件进行了探究,并在实验结束后进行了总结反思。
【提出问题】可燃物燃烧的条件是什么?
(1)【作出假设】假设1 :可燃物燃烧需要与氧气接触; 假设2 :可燃物燃烧需要温度达到其着火点; 假设3 :可燃物燃烧需要___________ 。
【查阅资料】白磷为白色蜡状固体,有剧毒,不溶于水,着火点为40 ℃;红磷的着火点为240 ℃。
(2)【进行实验】按A 装置进行实验,可观察到:
①铜片上的白磷燃烧,铜片上的红磷不燃烧,说明____________ ;
②铜片上的白磷燃烧,水下的白磷不燃烧,说明_________。
(3)【拓展探究】在使用组装好的B装置前,首先应该进行的操作是________,然后加入药品并将B装置和C装置连接。向B装置中滴入双氧水,C装置中水下的白磷也会燃烧。B装置中反应的化学方程式为_________,其中MnO2起__________作用。
(4)【得出结论】从以上实验可以得出可燃物燃烧的条件为____________。
(5)【总结反思】该实验在探究过程中运用了___________法,根据以上结论可推出,若可燃物着火,应采用__________的方法灭火。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案