
 锥形瓶及其中各物质的总质量、________.该方案有误差,请写出引起误差的一个原因:________.
锥形瓶及其中各物质的总质量、________.该方案有误差,请写出引起误差的一个原因:________.

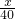 ×58.5
×58.5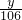 ×58.5
×58.5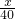 ×58.5+
×58.5+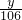 ×117=11.7 解得:x=4g;y=5.3g;
×117=11.7 解得:x=4g;y=5.3g;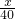 ×58.5+
×58.5+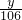 ×117=11.7;
×117=11.7;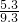 ×100%=57%;
×100%=57%;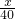 ×58.5+
×58.5+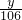 ×117=11.7; 57%.
×117=11.7; 57%.

科目:初中化学 来源: 题型:阅读理解
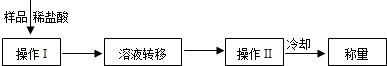
 锥形瓶及其中各物质的总质量、
锥形瓶及其中各物质的总质量、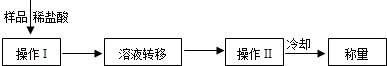
|
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
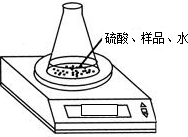
|
查看答案和解析>>
科目:初中化学 来源:2010年江苏省扬州中学树人学校中考化学一模试卷(解析版) 题型:解答题
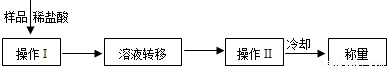
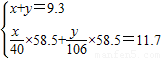
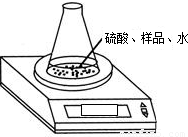
查看答案和解析>>
科目:初中化学 来源:2010年江苏省连云港市灌南县中考化学模拟试卷(七)(解析版) 题型:解答题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com