
【题目】钠的化合物在日常生活中有着广泛的应用.
(1)根据生活经验推测,汗水中产生咸味的物质可能是 , 该物质是由 (填“原子”、“分子”、“离子”)构成的;
(2)碳酸氢钠是发酵粉的有效成分,碳酸氢钠与稀盐酸反应的化学方程式为;
(3)盛放氢氧化钠的试剂瓶若密封不严会使氢氧化钠发生变质.氢氧化钠变质的原因是(用化学方程式表示);
(4)某无色溶液可能由氢氧化钠溶液、氯化钠溶液、碳酸钠溶液中的一种或几种混合而成.为探究其组成.小华同学进行了如下实验:取适量样品放入试管中,滴加酚酞溶液,溶液变成红色.再向试管中逐滴加入过量氯化钙溶液,观察到有沉淀产生,过滤后滤液仍为红色,由实验现象可推断出样品中一定含有的物质是 (写化学式),可能含有的物质是(写化学式);
(5)向氢氧化钠溶液中不断滴入盐酸,得到如图曲线,a点时溶液中的溶质是 . 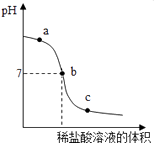
(6)食用纯碱中常含有少量的氯化钠.现取某食用纯碱样品10g,加入一定量稀盐酸溶液恰好完全反应,同时产生了3.3g气体,试计算该食用纯碱中Na2CO3的质量分数(写出计算过程)
【答案】
(1)氯化钠;离子
(2)NaHCO3+HCl=NaCl+H2O+CO2↑
(3)2NaOH+CO2═Na2CO3 +H2O
(4)NaOH和Na2CO3;NaCl
(5)氢氧化钠和氯化钠
(6)解:设纯碱样品中碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+ | CO2↑ |
106 | 44 |
x | 3.3 |
![]() =
= ![]()
解得:x=7.95g
食用纯碱中Na2CO3的质量分数 ![]() ×100%=79.5%
×100%=79.5%
答:食用纯碱中Na2CO3的质量分数为79.5%。
【解析】解:(1)根据生活经验推测,汗水中产生咸味的物质可能是氯化钠.氯化钠是由钠离子和氯离子组成的化合物.(2)碳酸氢钠能与盐酸反应生成氯化钠、水和二氧化碳,方程式是NaHCO3+HCl=NaCl+H2O+CO2↑;(3)氢氧化钠变质是氢氧化钠与空气中的二氧化碳反应生成了碳酸钠和水;故反应的化学方程式为:2NaOH+CO2═Na2CO3 +H2O;(4)酚酞试液在碱性溶液中为红色,加入酚酞试液溶液变成红色,说明溶液呈碱性;向试管中逐滴加入过量的氯化钙溶液,观察到有沉淀产生.碳酸钠能与氯化钙反应生成碳酸钙沉淀,说明溶液中一定含有碳酸钠;过滤,所得滤液为红色,说明滤液呈碱性,故溶液中一定含有氢氧化钠.(5)a点已经滴入一定量的盐酸,盐酸与氢氧化钠反应生成氯化钠,但溶液的pH值仍大于7,说明氢氧化钠还有剩余,故溶液中既有氢氧化钠又有氯化钠; 所以答案是:(1)氯化钠;离子;(2)NaHCO3+HCl=NaCl+H2O+CO2↑;(3)2NaOH+CO2═Na2CO3 +H2O(4)NaOH和Na2CO3;NaCl(5)氢氧化钠和氯化钠(6)79.5%
【考点精析】解答此题的关键在于理解中和反应及其应用的相关知识,掌握中和反应:酸与碱作用生成盐和水的反应,以及对根据化学反应方程式的计算的理解,了解各物质间质量比=系数×相对分子质量之比.


科目:初中化学 来源: 题型:
【题目】如图所示,取3根粗细、长度均相同的光亮细铁钉,其中两根放入经煮沸迅速冷却的蒸馏水中,A试管上方加一层植物油;C试管中的铁钉放在干燥的空气中,加盖密封.一段时间后观察到:A、C铁钉都没有生锈,而B中铁钉生锈.根据探究回答以下问题: 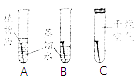
(1)A试管中加植物油的作用是什么?
(2)分析A、B、C试管中铁钉的锈蚀情况,因此可以得出铁制品锈蚀的条件是什么?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】废旧计算机的某些部件含有Zn、Fe、Cu、Ag、Pt(铂)、Au(金)等金属,经物理方法初步处理后,加入足量稀盐酸充分反应,过滤,所得的固体中不应有的金属是( )
A. Cu、Ag B. Zn、Fe C. Pt、Cu D. Au、Cu
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】煤、石油、天然气是当今世界上最重要的化石燃料,对这三种燃料的叙述不正确的是
A. 都是混合物 B. 燃烧后都会放出热量 C. 都是可再生能源 D. 都是重要的化工原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com