
【题目】为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行了如下探究:

(1)请写出H2O2溶液用FeCl3作催化剂分解的化学方程式_______________。
(2)如图甲,可通过观察_____来定性比较两者的催化效果,该实验控制的变量有_______。
(3)如图乙,实验前检查该装置气密性的方法是__________。要定量比较两者的催化效果,可测量生成等体积气体所需的____________。
(4)在FeCl3溶液中,究竟是哪种粒子起催化作用呢?
猜想1:铁离子起催化作用;猜想2:水分子起催化作用;猜想3:____起催化作用。
小明同学认为可以排除猜想2,他这样认为的原因是__________。
【答案】 化学方程式略 产生气体的快慢(答案合理即可) 过氧化氢溶液的浓度和用量、滴加催化剂的量 略(答案合理即可) 时间 氯离子(Cl-) 过氧化氢溶液中有水存在
【解析】根据所学知识和题中信息知,(1)H2O2溶液用FeCl3作催化剂分解的化学方程式∶2H2O2 ![]() 2H2O+O2↑。(2)如图甲,可通过观察产生气体的快慢来定性比较两者的催化效果,该实验控制的变量有过氧化氢溶液的浓度和用量、滴加催化剂的量。(3)如图乙,实验前检查该装置气密性的方法是推压注射器,然后松手,注射器回到原位,证明气密性良好。要定量比较两者的催化效果,可测量生成等体积气体所需的时间。(4)在FeCl3溶液中,究竟是哪种粒子起催化作用呢?猜想1:铁离子起催化作用;猜想2:水分子起催化作用;猜想3:氯离子(Cl-)起催化作用。小明同学认为可以排除猜想2,他这样认为的原因是过氧化氢溶液中有水存在。
2H2O+O2↑。(2)如图甲,可通过观察产生气体的快慢来定性比较两者的催化效果,该实验控制的变量有过氧化氢溶液的浓度和用量、滴加催化剂的量。(3)如图乙,实验前检查该装置气密性的方法是推压注射器,然后松手,注射器回到原位,证明气密性良好。要定量比较两者的催化效果,可测量生成等体积气体所需的时间。(4)在FeCl3溶液中,究竟是哪种粒子起催化作用呢?猜想1:铁离子起催化作用;猜想2:水分子起催化作用;猜想3:氯离子(Cl-)起催化作用。小明同学认为可以排除猜想2,他这样认为的原因是过氧化氢溶液中有水存在。
点睛∶本题主要考查比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果。


科目:初中化学 来源: 题型:
【题目】探究金属活动性顺序时,将锌粒放入硫酸铜溶液中,锌粒表面有紫红色物质析出,还有无色无味气体产生的“异常”现象.推测该气体可能是
A.氢气 B.二氧化硫 C.二氧化碳 D.一氧化碳
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列对实验现象的描述正确的是
A. 加热氢氧化铜悬浊液,产生紫红色固体
B. 木炭在空气中剧烈燃烧,发出耀眼白光
C. 点燃棉纱线,产生烧焦羽毛气味
D. 聚乙烯塑料加热时熔化,冷却后变成固体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列各组离子中,能大量共存的是
A. H+、SO42-、OH-、Ba2+ B. Na+、K+、Cl-、SO42-
C. Na+、H+、NO3-、CO32- D. K+、Mg2+、NO3-、OH-
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列各组离子在pH=13的溶液中能大量共存,并形成无色透明溶液的是
A. Na+、K+、Cl-、CO32- B. H+、Na+、CO32-、SO42-
C. NH4+、K+、NO3-、Cl- D. Cu2+、Ca2+、Cl-、NO3-
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】Cu可以形成化合价为+2和+1的化合物,其中+l价化合物称为亚铜化合物。
(1)高温时,氧化铜可被木炭还原为铜,反应的化学方程式是__________。
(2)氧化亚铜是一种红色粉末。加热时,氧化亚铜能与氧气发生化合反应,反应的化学方程式是________________________;利用这一性质可检验氮气中是否含有氧气(装置如图所示),判断氮气中含有氧气的现象是______________________________。
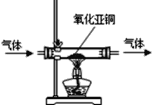
(3)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。
某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
【查阅资料】①Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
②Fe3+遇到KSCN试剂变红
【提出假设】 假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Cu2O和Fe2O3的混合物
【设计探究实验】 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
①若假设1成立,则实验现象是______________。
②若假设2成立,写出反应的化学方程式:_____________。
【探究延伸】若经实验分析,确定红色粉末为Cu2O和Fe2O3的混合物。
实验小组欲用加热法测定Cu2O的质量分数。取a克固体粉末在空气中充分加热,待质量不在变化时,称其质量为b克(b>a),则混合物中Cu2O的质量分数为________________%。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镁条在空气中久置表面会变黑。某小组同学设计并进行实验,探究镁条变黑的条件。
【查阅资料】
常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】
常温下,镁条变黑可能与O2、CO2、水蒸气有关。
【进行实验】
通过控制与镁条接触的物质,利用下图装置(镁条长度为3cm,试管容积为20mL,试剂量合适),分别进行下列5个实验,并持续观察20天。

实验现象:实验1、2、3、4中镁条始终无明显变化,实验5中镁条第3天开始变黑,至第20天全部变黑
【解释与结论】
(1)实验1和2中,NaOH溶液的作用是_______________(用化学方程式表示)。
(2)实验1的目的是______________。
(3)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是__________(填编号)。
(4)由上述实验可推知,镁条变黑的条件是_______________。
【反思与评价】
(5)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是______________。
(6)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com