
【题目】下列说法中正确的是
A.质量相等的氧化镁和硫酸镁中镁元素的质量比为1:3
B.质量相等的硫和碳分别在氧气中充分燃烧,硫比碳消耗氧气的质量大
C.硝酸铵和氯化钾混合物中氮元素质量分数为14%,该混合物中硝酸铵质量分数为40%
D.质量和质量分数均相等的氢氧化钠溶液和稀硫酸,充分反应后,向所得溶液中滴加紫色石蕊溶液,溶液呈蓝色
【答案】CD
【解析】
A、解:氧化镁和硫酸镁的质量都为m,质量相等的氧化镁和硫酸镁中镁元素的质量比为=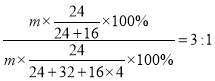 ;故选项错误;
;故选项错误;
B、解:设碳粉和硫粉的质量都为m,碳消耗的氧气质量为x,硫消耗的氧气质量为y

![]() x=
x=![]()
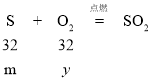
![]() y=
y=![]()
x>y;
质量相等的硫和碳分别在氧气中充分燃烧,碳比硫消耗氧气的质量大;故选项错误;
C、解:令混合物的质量为1,设混合物中硝酸铵的质量分数为x
一个硝酸铵分子中含有2个氮原子,则关系如下:
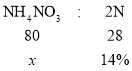
![]() x=40%
x=40%
该混合物中硝酸铵质量分数为40%;故选项正确;
D、由化学方程式可知:2NaOH+H2SO4=Na2SO4+2H2O,80份氢氧化钠与98份硫酸恰好完全反应,质量和质量分数均相等的氢氧化钠溶液和稀硫酸,充分反应后,氢氧化钠有剩余,溶液显碱性,向所得溶液中滴加紫色石蕊溶液,溶液呈蓝色;故选项正确;
故选:CD。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:初中化学 来源: 题型:
【题目】根据下图所示的实验回答问题。
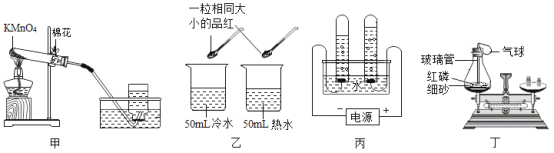
(1)甲中的化学方程式是______________。
(2)乙的目的是研究品红分子在水中的运动速率与_______________的关系。
(3)丙是电解水实验,反应的化学方程式为_______________;与电源正极相连的试管中产生的气体是______________。
(4)丁是验证质量守恒定律。其中红磷燃烧的化学方程式为____________;充分反应并冷却后,天平 仍保持平衡,从微观的角度解释其原因:_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学设计的工业制备氢氧化钠的流程如下图。

资料: ,两电极,一端得到NaOH和H2,另一端得到Cl2。
,两电极,一端得到NaOH和H2,另一端得到Cl2。
(1)实验室进行蒸发操作时用到的仪器有铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒和________,蒸发过程中用玻璃棒不断搅动的目的是_________。
(2)Cl2可用于生产84消毒液(有效成分NaClO),反应原理为![]() ,X的化学式为_______,反应前后氯元素的化合价共有________种。
,X的化学式为_______,反应前后氯元素的化合价共有________种。
(3)加热浓缩过程中(没有晶体析出),溶液中始终没有发生改变的量是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一瓶含杂质的氯酸钾。化学小组取这种氯酸钾30g,加入二氧化锰,制取氧气(杂质不参加反应),加热充分反应后,收集到氧气9.6g,冷却后称量剩余固体质量为28.4g,反应的化学方程为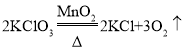
(1)加入二氧化锰的质量为 g。
(2)该氯酸钾的质量分数(写出计算过程,结果精确到 0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E均为初中化学常见的物质,其中A是单质,B.C.D.E都是化合物。它们之间的部分转化关系如图所示(部分反应物、生成物和反应条件已略去。“一” 表示物质之间能发生化学反应,“→”表示一种物质在一定条件 下转化为另一种物质)。
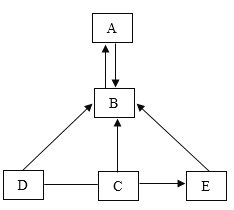
(1)若A能供呼吸,C为白色固体氧化物,D与E反应的化学方程式是___。
(2)若A是红色固体,C是黑色固体氧化物,则B的化学式是__,E→B转化的反应的化学方程式是______(任写一个即可)。
(3)若A是目前工业上产量最高的金属,C是酸,则B的物质类别是___,C和D反应的化学方程式是____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常会产生含硫酸的废水,需经处理至中性。某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水。
(1)测定废水pH的方法是______。
(2)配制200 g质量分数为5.6%的氢氧化钾溶液
①计算:m(KOH)=___g,V(H2O)=______mL(水的密度近似为1.0gmL-1)
②称取氢氧化钾:调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量.然后____(按操作先后顺序,填字母),直至天平平衡。
A 向烧杯中加氢氧化钾固体
B 按需要添加砝码、移动游码
③量取水: ④溶解; ⑤转移。
(3)定量测定废水:取酸性废水样品100g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如图所示。(假设废水中其他成分不与氢氧化钾反应)
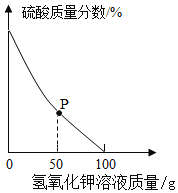
①P点对应溶液中一定存在的阳离子有_____(填离子符号)。
②废水中硫酸的质量分数为______(结果保留到0.1%).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】U形管在实验中有广泛的应用。
实验一:探究分子的性质 | 实验二:验证氧化钙的性质 | 实验三: 探究金属的活动性强弱 | 实验四:实验室制取二氧化碳 |
|
|
|
|
①实验一:说明分子具有的性质是_____________。
②实验二:观察到的现象是___________, 反应的化学方程式为_________。
③实验三:能证明金属活动性Fe>Cu>Ag的现象是__________,反应一会儿后取出两种金属,溶液中溶质的存在情况是_________________。
④实验四:为了达到“随开随用,随关随停”的要求,装置的改进措施是___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合配制245g质量分数为20%的稀 H2SO4溶液的实验,回答下列问题。
(1)计算:需要质量分数为 98%的浓H2SO4溶液_______g;
(2)量取:量取所需的水时俯视读数,其他操作均正确,则配制出的稀溶液的质量分数_______20%(选填“大于”、“等于”或“小于”);
(3)混匀:将准确量取的水和浓 H2SO4 依次倒入_______(填写一种仪器名称)中,用玻璃棒搅拌,使产生的热量随时散发掉并使溶液混合均匀;
(4)装入试剂瓶中,贴好标签,密封保存。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与生产、生活息息相关,请你用所学化学知识回答下列问题。
(1)用洗涤剂去除油污,是利用洗涤剂的_____作用。
(2)用灯帽盖灭酒精灯火焰的原理是_______。
(3)打开汽水瓶盖时,汽水会自动喷出来,说明气体在水中的溶解度随_______而减小。
(4)在电解水的实验中,一段时间后,正、负极产生气体的体积比约为______。
(5)二氧化碳是参与破循环的主要物质,固态的二氧化碳叫做____,常用于人工降雨:海水能够吸收大量CO2,吸收过程中发生的反应之一为______(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com