
【题目】科学方法对化学学习起着事半功倍的作用。右图是某同学整理的铁及其化合物知识网络图。
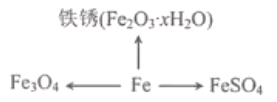
(1)分类归纳是研究化学物质的重要方法。① 铁丝燃烧生成Fe3O4的过程中________(选填”放出”或“吸收”)热量。
② 铁制品的锈蚀过程,实际上是铁与空气中的______等发生化学反应的过程。
③ 与FeSO4中铁元素化合价相同的铁氧化物的化学式是______。
(2)微观粒子模型化是研究化学变化的重要方法。
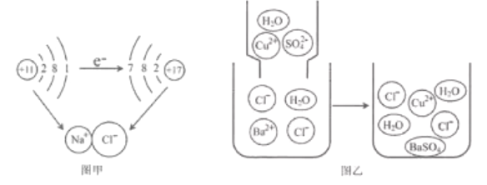
① 图甲是钠与氯气反应生成氯化钠的示意图。该图说明在化学反应过程中一定发生变化的是________。(填字母)
a.原子核 b.原子的最外层电子数 c.原子的电子层数
② 图乙是硫酸铜溶液与氯化钡溶液反应示意图。从粒子角度分析该化学反应能发生的原因是_________。
(3)控制变量、设计对比实验是实验探究的重要方法。
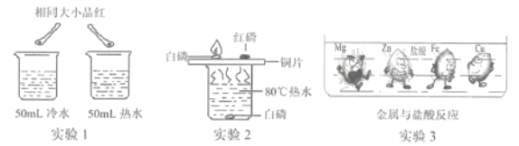
① 实验l 中同时向烧杯中加入一粒相同大小的品红,发现整杯水变红的时间热水比冷水短。这是因为__________。
② 实验2中使用铜片是为了对比__________不同。
③ 实验3是大小形状相同的Mg、Zn、Fe、Cu四种金属同时投入到盐酸中发生的现象,金属周围的黑点表示生成的气体。下列结论不正确的是__________。(填字母)
a.铜不能发生置换反应
b.四种金属中金属活动性最强的是Mg
c.等质量的锌和铁分别与足量的盐酸反应生成气体质量:Zn比Fe多
【答案】(l)① 放出 ②O2和H2O ③ FeO﹙2)① b ;② Ba2+和SO42-结合生成难溶于水的BaSO4沉淀(3)① 受热的情况下,分子能量增大,运动速率加快。② 可燃物燃烧所需的最低温度(或可燃物的着火点)。③ a 、c。
【解析】根据所学知识和题中信息知,(1)分类归纳是研究化学物质的重要方法。① 铁丝燃烧生成Fe3O4的过程中放出热量。② 铁制品的锈蚀过程,实际上是铁与空气中的O2和H2O 等发生化学反应的过程。③ 与FeSO4中铁元素化合价是+2价,相同的铁氧化物的化学式是FeO。(2)微观粒子模型化是研究化学变化的重要方法。① 实验l 中同时向烧杯中加入一粒相同大小的品红,发现整杯水变红的时间热水比冷水短。这是因为受热的情况下,分子能量增大,运动速率加快。② 实验2中使用铜片是为了对比可燃物燃烧所需的最低温度(或可燃物的着火点)不同。③ 实验3是大小形状相同的Mg、Zn、Fe、Cu四种金属同时投入到盐酸中发生的现象,金属周围的黑点表示生成的气体。a.铜不应盐酸发生置换反应,不是不能发生置换反应,铜排在氢后。故a错误。b.四种金属中金属活动性最强的是Mg ,由金属活动性顺序知。故b正确。c.等质量的锌和铁分别与足量的盐酸反应生成气体质量:铁比锌多。故c错误。


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:
【题目】现有 H2SO4、 NaOH、 Na2CO3、 Ca(OH)2、 BaCl2五种溶液和 CO2 一种气体(用 A、B、C、D、E、F 各代表这六种物质中的一种),它们之间的相互反应关系如右图所示,图中每条连线表示两端的物质可以发生化学反应. 请分析后回答:

(1)C 的化学式是___________。
(2)B 和 D 反应的化学方程式_______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示是四种物质的溶解度曲线图,请回答下列问题。

(1)在60℃时,四种物质中溶解度最大的是 。
(2)将40℃时氯化钾的不饱和溶液,保持溶液温度不变,制成饱和溶液,可行的方法有 (举1例)。
(3)在t℃时,将30g氯化铵加入50g水中,充分溶解,所得溶液质量分数为 (精确到0.1%)。
(4)向饱和食盐水中加入足量的碳酸氢铵固体,会有溶解度较小的碳酸氢钠晶体析出,该反应的化学方程式是NaCl+NH4HCO3 =NaHCO3↓+NH4Cl,请根据以上信息和题13图中物质的溶解度曲线,简述以硫酸铵固体为原料制取较纯硫酸钾晶体的方法: 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是一种高效多功能水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产,反应原理用化学方程式表示为:3NaClO + 2Fe(NO3)3 + 10NaOH = 2Na2FeO4↓+3NaCl +6NaNO3 + 5H2O
(1)在Fe(NO3)3中,铁元素和氮元素的质量比为 (填最简比)。
(2)县称取44.7g次氯酸钠,最多能制得高铁酸钠的质量是多少?(列式计算)
温馨提示:NaClO的相对分子质量为74.5;Na2FeO4的相对分子质量为166。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】健康的身体离不开合理的饮食和健康的生活方式。下列说法错误的是( )
A.多吃富含维生素的蔬菜水果 B.提倡绿色出行,减少机动车废气排放
C.不吸烟,不沾染毒品 D.食盐中加碘,碘元素的摄入越多越好
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验窒常会产生含硫酸的废水,需经处理至中性。某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水。
(1)定性检测废水
检测废水呈酸性的方法是_____________。
(2)配制200 g质量分数为5.6%的氢氧化钾溶液
①计算
m (KOH)=_______g,V(H2O)=________mL(水的密度近似为1.0 g·mL-1)。
②称取氢氧化钾
调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量。然后______(按操作先后顺序,填字母),直至天平平衡。
A.向烧杯中加氢氧化钾同体 B.按需要添加砝码、移动游码
③量取水;④溶解;⑤转移。
(3)定量测定废水
取酸性废水样品100 g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如右下图所示。(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)
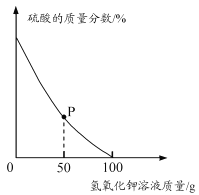
①P点对应溶液中一定存在的阳离子有_______(填离子符号)。
②酸性废水中硫酸的质量分数为______(用百分数表示,保留到0.1%)。
③计算当废水处理至中性时,溶液中硫酸钾的质量分数(写出计算过程,结果用百分数表示,保留到0.l%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com