某温度下,氯化铁饱和溶液的质量分数为10%.现取162.5克该氯化铁饱和溶液,与82.2克一定浓度的氢氧化钠恰好反应.试求:
(1)氯化铁饱和溶液中溶质的质量,
(2)生成沉淀的质量,
(3)反应后溶液的质量分数.
解:(1)氯化铁饱和溶液中溶质的质量为:162.5g×10%=16.25g
(2)设生成沉淀氢氧化铁的质量为x,生成氯化钠的质量为y
FeCl
3+3NaOH═Fe(OH)
3↓+3NaCl
162.5 107 175.5
16.25g x y
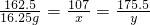
x=10.7g y=17.55g
(3)反应后溶液的质量分数=
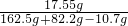
×100%=7.5%
答:(1)氯化铁饱和溶液中溶质的质量为16.25g,
(2)生成沉淀氢氧化铁的质量为10.7g
(3)反应后氯化钠溶液的质量分数为7.5%.
分析:(1)根据氯化铁溶液的质量和溶质质量分数可计算氯化铁饱和溶液中溶质的质量;
(2)根据反应的化学方程式FeCl
3+3NaOH═Fe(OH)
3↓+3NaCl,由氯化铁的质量计算恰好完全反应时生成沉淀的质量;
(3)反应后的溶液为氯化钠溶液,需要根据反应计算出氯化钠的质量、利用质量守恒定律计算出溶液的质量,再利用溶液中溶质的质量分数计算公式求出反应后溶液的质量分数.
点评:利用质量守恒定律可完成反应后所得溶液的质量的计算,反应后所得溶液质量=硫酸铜溶液的质量+氢氧化钠溶液的质量-沉淀氢氧化铜的质量.

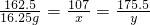
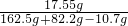 ×100%=7.5%
×100%=7.5%