
 我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:| 温度 物质 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
| 温度 物质 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
| 18 |
| 68 |


科目:初中化学 来源: 题型:
 (2007?湘潭)在我国某地区有一种“冬天捞碱,夏天晒盐”的说法.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中含有少量的NaCl.
(2007?湘潭)在我国某地区有一种“冬天捞碱,夏天晒盐”的说法.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中含有少量的NaCl.查看答案和解析>>
科目:初中化学 来源: 题型:
我国某地区有一种“冬天捞碱,夏天晒盐”的说法,这里的“碱”是指Na2CO3,“盐”是指NaCl。这样捞得的“碱”中含有少量NaCl。某化学课外活动小组为了解释捞碱、晒盐的原理和测定“碱”样品中Na2CO3的含量进行了以下探究。
[查阅资料]
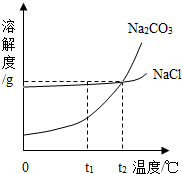
Na2CO3和NaCl的溶解度曲线如图所示。
(1)根据图示回答:①t1 ℃时Na2CO3的溶解度为________ g;t2 ℃时Na2CO3的溶解度________(填“>”“=”或“<”)NaCl的溶解度。
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度的降低而________(填“增大”“减小”或“不变”)。
③“夏天晒盐”是利用________(填字母)的方法,使NaCl晶体析出。

A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl的溶解度增大
[实验步骤]
第一步:称取34.6 g“碱”样品。
第二步:将该样品放入13 0 g稀盐酸中,两者恰好完全反应。其化学方程式为Na2CO3+2HCl===2NaCl+H2O+CO2↑
0 g稀盐酸中,两者恰好完全反应。其化学方程式为Na2CO3+2HCl===2NaCl+H2O+CO2↑
第三步:完全反应后,称得溶液的总质量为151.4 g,经计算可知释放出的二氧化碳的质量为13.2 g。
[数据分析]
(2)试计算:(结果保留一位小数)
①Na2CO3的相对分子质量。②34.6 g“碱”样品中碳酸钠的质量。③“碱”样品中Na2CO3的纯度。
[继续探究]
(3)计算反应后所得溶液中NaCl的质量分数。
查看答案和解析>>
科目:初中化学 来源:2013年北京市门头沟区中考化学二模试卷(解析版) 题型:填空题
| 温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com